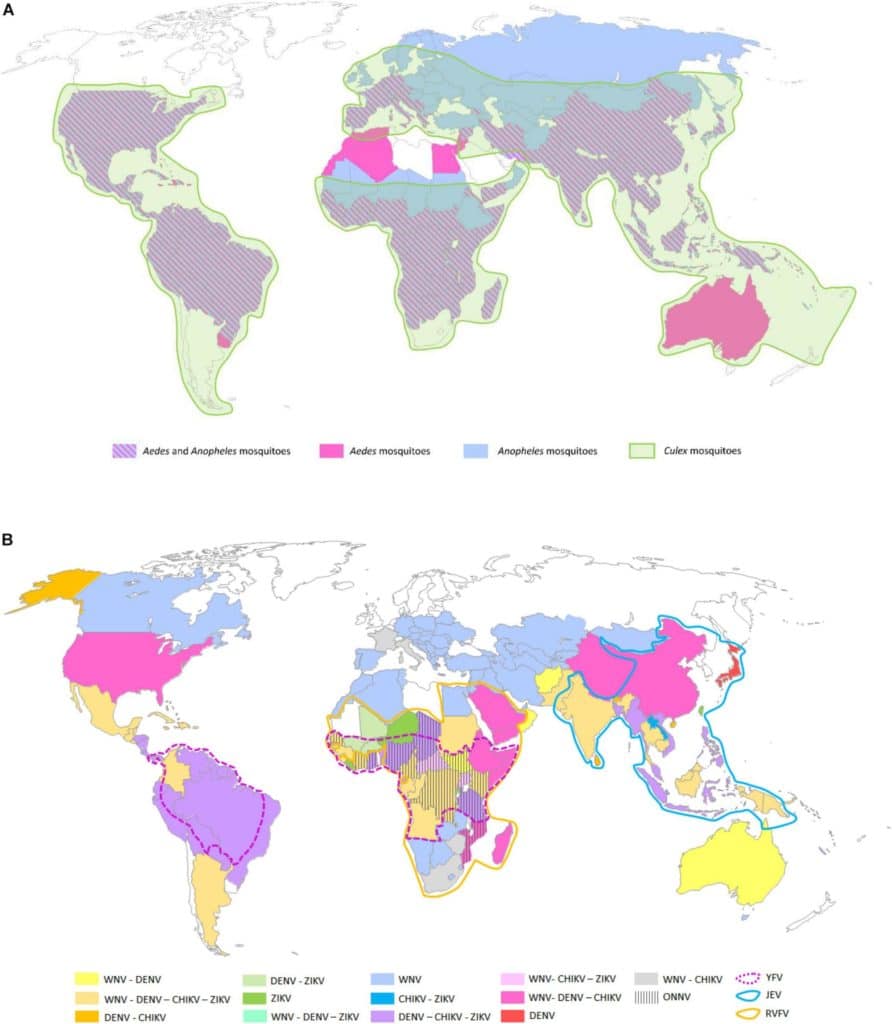
Les maladies à transmission vectorielle sont responsables de plus de 17% des mortalités dues aux maladies infectieuses. Elles nécessitent l’intervention d’un arthropode hématophage (insecte ou tique) qui assure la transmission biologique de l’agent pathogène d’un hôte vertébré à un autre. Les moustiques du genre Aedes sont les vecteurs les plus importants d’arbovirus (dengue, chikungunya, ou Zika). Dans une moindre mesure, les moustiques du genre Culex sont vecteurs d’autres arbovirusArbovirose Les arboviroses sont des maladies virales dues à des arbovirus transmis obligatoirement par un vecteur arthropode (moustique, moucheron piqueur, tique) à des hôtes vertébrés (mammifères, oiseaux), d’où leur nom adapté de l’anglais : ARthropod-BOrne virus. tels que ceux de l’encéphalite japonaise, le West Nile ou Usutu. De façon surprenante, les moustiques du genre Anopheles sont les vecteurs du parasite Plasmodium à l’origine du paludisme mais interviennent très peu dans la transmission des arbovirus.
Le cycle de transmission
La transmission horizontale assure la transmission du virus d’un hôte vertébré à un autre hôte par l’intermédiaire de la piqûre d’un arthropode vecteur. Les arbovirus sont à l’origine entretenus au sein d’un cycle enzootique entre animaux réservoirs majoritairement des mammifères (rongeurs, singes, chauve-souris) ou des oiseaux et des vecteurs zoophiles (piquant essentiellement les animaux). Par la suite, certains arbovirus «s’échappent» du cycle enzootique pour assurer une transmission à l’homme par l’intermédiaire de moustiques anthropo-zoophiles assurant le passage du virus de l’animal infecté à l’homme à l’origine d’un cycle intermédiaire. L’homme en milieu urbain agit alors comme un hôte amplificateur dans un cycle épidémique ; il est capable de développer une virémie suffisante pour infecter des vecteurs anthropophiles tels que Aedes aegypti et Aedes albopictus (dengue, chikungunya et Zika). L’homme peut également être une impasse épidémique, un hôte définitif ou accessoire qui ne contribue pas au cycle de transmission ; il ne développe pas une virémie suffisamment élevée et de longue durée permettant l’infection des vecteurs (cas du West Nile et Usutu). L’initiation des épidémies urbaines peut conduire à la propagation de la maladie par le déplacement des voyageurs infectés qui deviennent la source de contamination des moustiques vecteurs omniprésents dans les villes tropicales et même tempérées, ce qui conduit à une pandémie telle que celle du chikungunya en 2004 et du Zika en 2007, sans oublier celle de la dengue qui affecte encore aujourd’hui 128 pays et 390 millions de personnes par an.
Les deux principaux moustiques vecteurs
On compte plus de 3 500 espèces de moustiques dont moins de 15% piquent l’homme. Les moustiques Ae. aegypti et Ae. albopictus figurent parmi les espèces les plus anthropophiles du genre Aedes. Les cycles de développement de ces deux espèces sont quasi identiques et durent en moyenne entre 10 et 14 jours. Cette durée augmente avec la température ambiante: elle sera plus courte pour les températures élevées (> à 28°C) et plus longue pour les températures plus basses (< à 28°C). Les œufs pondus par les femelles éclosent 24 à 48h après contact avec l’eau, libérant des larves aquatiques ; il y a quatre stades larvaires successifs et un stade nymphal. L’adulte émerge de la nymphe passant du stade aquatique au stade aérien. Seules les adultes femelles piquent grâce à un proboscis (organe en forme de trompe) long et rigide pour transpercer la peau de l’hôte. La reproduction intervient généralement dans les jours suivant l’émergence. Les femelles, même si elles peuvent s’accoupler avec plusieurs mâles, ne seront inséminées que par un seul. Avec les spermatozoïdes entreposés dans les spermathèques, la femelle va fertiliser ses œufs durant toute sa vie avec ce même stock. Les mâles et les femelles se nourrissent de liquide sucré qu’ils trouvent généralement dans les végétaux (sève d’arbres, exsudat de fruits, nectar de fleur…). Au cours de sa vie, la femelle moustique effectue plusieurs repas de sang pour compléter entre 5 à 8 cycles de ponte.
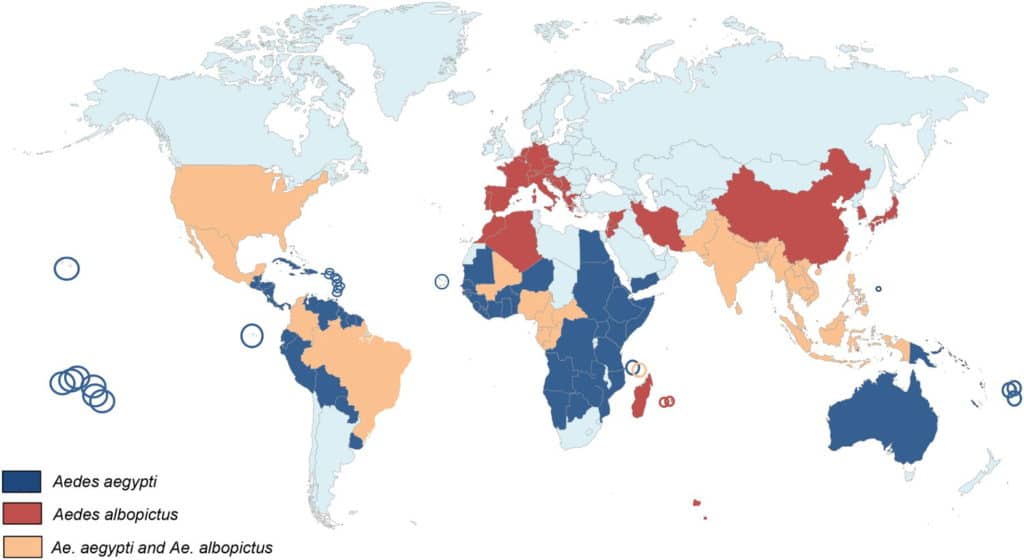
Les moustiques Ae. aegypti et Ae. albopictus sont qualifiés d’espèces invasives dont l’expansion est principalement liée aux activités humaines et à l’intensification des échanges entre pays. Leur biologie est adaptée aux trajets sur de longues distances sous forme d’œufs.
Aedes aegypti
Le moustique Ae. aegypti d’origine africaine est décrit sous deux formes principales : Ae. aegypti formosus et Ae. aegypti aegypti. Ae. aegypti formosus est la forme ancestrale essentiellement présente en Afrique tropicale et dans quelques îles de l’océan Indien. Cette espèce prend principalement ses repas de sang sur les animaux et colonise des gîtes naturels (creux d’arbre, trous de rochers). Ae. aegypti aegypti, issu d’Ae. aegypti formosus, est une espèce hautement anthropophile et inféodée à l’homme. Il a colonisé le monde : le nouveau monde lors de la traite des esclaves entre le 15e et le 19e siècle, à partir de l’Afrique de l’Est vers l’Asie entre le 18e siècle et le 19e siècle favorisé par le développement du commerce maritime (cette espèce est devenue l’espèce la plus importante d’Asie) et (lors de la 2e Guerre Mondiale de l’Asie vers le Pacifique à la faveur des déplacements des troupes. Ae. ae. aegypti a été présent dans le bassin méditerranéen au début 20e siècle mais a ensuite disparu suite aux mesures d’assainissement et d’épandages d’insecticides.
Aedes albopictus
Le moustique Ae. albopictus d’origine asiatique aussi appelé «moustique tigre», était cantonné à l’Asie du Sud-Est et aux îles de l’océan Indien et du Pacifique. À la fin des années 1970, Ae. albopictus a entamé sa phase d’expansion: Europe en 1979 (Albanie), États-Unis en 1983, Amérique du Sud en 1986, Caraïbes à partir de 1993, Afrique dès 1989. Le moustique est présent dans plus de 28 pays européens et est installé en France depuis 2004. Il est capable de coloniser les régions tropicales et tempérées, car les œufs d’Ae. albopictus sont capables d’entrer en diapause pour survivre aux basses températures de l’hiver. Ae. albopictus peut ainsi coloniser les gîtes naturels comme les gîtes artificiels, piquer l’homme ou l’animal, et être présent en ville comme en forêt.
La lutte contre les arbovirosesArbovirose Les arboviroses sont des maladies virales dues à des arbovirus transmis obligatoirement par un vecteur arthropode (moustique, moucheron piqueur, tique) à des hôtes vertébrés (mammifères, oiseaux), d’où leur nom adapté de l’anglais : ARthropod-BOrne virus.
Le vaccin contre la fièvre jaune est l’exemple emblématique du rôle de la vaccination pour lutter contre une arboviroseArbovirose Les arboviroses sont des maladies virales dues à des arbovirus transmis obligatoirement par un vecteur arthropode (moustique, moucheron piqueur, tique) à des hôtes vertébrés (mammifères, oiseaux), d’où leur nom adapté de l’anglais : ARthropod-BOrne virus. La découverte de la transmission du virus de la fièvre jaune par le moustique en 1900 (par Carlos Finlay et Walter Reed) a permis de contrôler les épidémies de fièvre jaune en menant des campagnes de désinsectisation visant le moustique Ae. aegypti. Suite à l’isolement du virus en 1927, le vaccin 17D a été développé en 1937 par passages successifs du virus sur des cellules de souris et des embryons de poulet conduisant à une atténuation avec réduction des complications viscérotropes (fixées sur les viscères). Il est considéré comme l’un des vaccins les plus sûrs et efficaces. Hormis le vaccin 17D, peu de vaccins sont disponibles à ce jour contre les arbovirus. De plus, il n’existe actuellement aucun traitement spécifique. La lutte contre le vecteur reste un élément essentiel de prévention d’une maladie vectorielle.
La lutte antivectorielle (LAV) consiste à agir sur les vecteurs plutôt que sur les virus. Elle a pour but ultime de diminuer les densités de vecteurs et réduire la transmission des virus.
La lutte physique
La lutte physique permet de réduire le contact entre le vecteur et l’hôte vertébré. Elle inclut la réduction de la densité des vecteurs par la destruction des gîtes larvaires ou encore l’utilisation de pièges (BG sentinelle, piège lumineux). Elle passe également par la mise en place de protection individuelle notamment par l’application de répulsifs, l’utilisation de moustiquaires (imprégnées ou non d’insecticides), la pose d’écrans de protection (type moustiquaire) aux portes et fenêtres des habitations ou encore le port de vêtements longs et de couleur claire imprégnés ou non d’insecticides. Ce mode de LAV nécessite des mesures d’hygiène publique et de gestion des déchets ménagers extrêmement contraignantes. L’implication de la population est nécessaire pour avoir un impact significatif sur la réduction de la densité des moustiques.
La lutte chimique
La lutte chimique est la méthode la plus largement utilisée depuis les années 1940. Elle consiste en l’utilisation d’insecticides d’origine chimique, bactérienne ou végétale regroupés en une trentaine de familles d’insecticides. Les insecticides diffèrent par leur formulation, leur mode/mécanisme d’action sur la physiologie de l’insecte et leur efficacité. Les insecticides chimiques incluent les familles des organochlorés, des carbamates, des organophosphorés, des pyréthrinoïdes, et des régulateurs de croissance.
Les pyréthrinoïdes sont les insecticides les plus utilisés comme adulticides. Ce sont des dérivés synthétiques des pyréthrines naturelles extraites des fleurs de chrysanthème. Ces insecticides sont les plus largement utilisés dans la LAV en santé publique et vétérinaire en raison de leur faible toxicité pour les mammifères et leurs propriétés biodégradables. Ils agissent sur le système nerveux central et périphérique des insectes en affectant la transmission de l’influx nerveux, ce qui conduit à la paralysie et à la mort de l’insecte.
Les biocides tels que la bactérie Bacillus thuringiensis serovar israelensis (Bti) sont utilisées comme larvicides. Une fois ingérées par les larves, les bactéries sous l’action du pH basique de l’intestin libèrent leurs protoxines composées de cristaux protéiques toxiques, qui une fois activées par les enzymes digestives, altèrent les cellules épithéliales intestinales et entrainent la mort des larves.
La résistance aux insecticides
La mauvaise utilisation des insecticides (peu de molécules disponibles, sous-dosage, utilisations répétées…) a abouti à la sélection de moustiques résistants aux insecticides. Il existe deux types de résistance aux insecticides : la résistance génétique et la résistance métabolique.
La résistance génétique par modification de cible provient de mutations ponctuelles sur les gènes codant pour les protéines ciblées par l’insecticide. Cela conduit à une diminution de l’affinité de l’insecticide pour ces protéines cibles (récepteurs ou enzymes). Les principales mutations retrouvées chez les moustiques concernent l’acétylcholinestérase, le canal sodium voltage dépendant ou le récepteur de l’acide gamma-aminobutyrique.
La résistance métabolique ou mécanisme de détoxification est un mécanisme biochimique par lequel l’insecte synthétise des enzymes permettant la dégradation des insecticides en métabolites moins ou non toxiques. L’insecticide perdra alors de son efficacité car la quantité de produits insecticides atteignant la cible sera drastiquement réduite. Ce processus implique une surproduction d’enzymes estérases (carboxyestérases, glutathion-S-transférases, cytochrome P450) par amplification génique avec une augmentation du nombre de copies du gène, ii) mutation du promoteur du gène augmentant sa transcription, iii) mutations multiples augmentant les propriétés catalytiques de l’enzyme pour l’insecticide.
Les méthodes alternatives
Suite à l’identification de la résistance aux divers insecticides proposés, des méthodes alternatives de lutte issues de la biotechnologie ont été développées.
La technique de l’insecte stérile vise la réduction de la densité d’une population de moustiques via le lâcher massif de mâles stérilisés par irradiation aux rayons (X ou γ). Les mâles stérilisés s’accoupleront avec des femelles sauvages induisant ainsi la stérilisation des femelles. Cette technique est en cours de développement contre les Aedes. Une des limites de cette technique est la perte de compétitivité des mâles irradiés et la fécondation des femelles par un seul mâle.
La technique du lâcher de moustiques portant un gène létal dominant ou RIDL (Release of Insects Carrying a Dominant Lethal Gene) vise à réduire la densité de moustiques. Des adultes d’Ae. aegypti génétiquement modifiés sont produits par la compagnie Oxitec par l’insertion d’un transposon (séquence d’ADN capable de se déplacer de manière autonome dans un génome) exprimant le facteur de transcription tTAV (Tetracycline-controlled transactivator) qui permet la survie des adultes dans un milieu contenant de la tétracycline. Le milieu naturel étant dépourvu de tétracycline, les moustiques génétiquement modifiés transmettent lors de l’accouplement ce gêne dominant létal à leur descendance, conduisant à la mort des individus en l’absence de tétracycline.
La technique Wolbachia
Contrairement à Ae. albopictus, Ae. aegypti est naturellement dépourvu de la bactérie intracellulaire Wolbachia. La transfection de wMelPop issus de Drosophila melanogaster (la mouche drosophile) chez Ae. aegypti conduit à une diminution des densités de populations due au phénomène d’incompatibilité cytoplasmique se traduisant par une stérilité produite lors de l’accouplement (une femelle et un mâle infectés par des souches de Wolbachia différentes), la diminution de la compétence vectorielle pour différents arbovirus et la réduction de la durée de vie du moustique. Le World Mosquito Program a lancé des programmes de lâchers de moustiques avec Wolbachia depuis 2011 pour réduire le risque de transmission de virus par Ae. aegypti dans 13 pays.
L’intensification des échanges commerciaux et de passagers favorise le transport des insectes (principalement sous forme d’œufs) et la circulation des agents pathogènes. L’aire de distribution des vecteurs va s’agrandir installant le terreau pour l’implantation des arbovirus véhiculés par l’homme. Les épisodes épidémiques récents de chikungunya et de Zika nous rappellent que les priorités doivent se porter sur le développement d’un vaccin qui devra être associé à des mesures de lutte antivectorielle beaucoup plus efficaces.
