Ces recommandations, qui sont rassemblées dans le Rapport d’expert disponible sur le site du CNS, visent à moderniser la prévention à l’heure de ces outils cruciaux et à en élargir l’accès, en particulier auprès des populations qui sont exposées face au VIHVIH Virus de l’immunodéficience humaine. En anglais : HIV (Human Immunodeficiency Virus). Isolé en 1983 à l’institut pasteur de paris; découverte récemment (2008) récompensée par le prix Nobel de médecine décerné à Luc montagnier et à Françoise Barré-Sinoussi. sans toujours en être conscientes. Trois documents sont disponibles sur le site: la fiche synthétique, les recommandations proprement dites et le rationnel de celles-ci; pas facile d’identifier ce qui est déjà connu, les nouveautés et même qui s’expose à devenir obsolète compte tenu de l’évolution rapide des molécules qui arrivent en PrEPPrEP Prophylaxie Pré-Exposition. La PrEP est une stratégie qui permet à une personne séronégative exposée au VIH d'éliminer le risque d'infection, en prenant, de manière continue ou «à la demande», un traitement anti-rétroviral à base de Truvada®. et la lenteur de ces recommandations depuis qu’elles sont sous la co-responsabilité de la HAS.
PrEP: Élargissement, simplification ou complexification?
Ces nouvelles recommandations réaffirment l’importance de la prophylaxie pré-exposition (PrEP) du VIH comme outil à part entière de la stratégie de prévention de l’infection par le VIH et insistent sur son efficacité démontrée. «Toute personne ayant un haut risque d’exposition au VIH doit pouvoir bénéficier de la PrEP.»
Les indications de la PrEP sont élargies. L’objectif est d’inclure non seulement les personnes à haut risque d’exposition, mais aussi celles qui en font la demande, même si elles ne présentent pas de facteurs de risque évidents. Cette approche vise à réduire le nombre de nouvelles infections chez des personnes qui auraient pu bénéficier de la PrEP.
Un accent particulier est mis sur l’amélioration de l’accès à la PrEP pour les jeunes femmes originaires d’Afrique subsaharienne, une population fortement touchée par le VIH mais sous-représentée parmi les utilisateurs. Pour faciliter cet accès, l’élargissement des prescripteurs à des professionnels, comme les infirmier(e)s dans le cadre de protocoles de coopération comme c’est déjà le cas dans certains services et des sages-femmes est recommandé.
Les recommandations 2024 insistent sur la simplicité de prescription et de surveillance de la PrEP, par tout médecin en ville comme à l’hôpital ou dans les centres de santé, sans consultation hospitalière systématique. Pour la PrEP orale, la surveillance de la tolérance biologique est minimale, avec un contrôle occasionnel des transaminases et de la créatininémie. Néanmoins, dans le cadre de l’offre de santé sexuelle globale, les recommandations sont celles d’une consultation de suivi «de façon régulière (en fonction des besoins du patient et des modalités de Prep, tous les 2 à 6 mois»). Ce pour évaluer la tolérance et l’efficacité de la PrEP, rechercher des ISTIST Infections sexuellement transmissibles. À noter que ce document HAS/CNS/ANRS-MIE ne se positionne pas sur ce que nous avons baptisé le «Belgium Statement», à savoir l’arrêt du dépistage régulier des IST asymptomatiques chez les HSH non bi. Les deux schémas de prises, en continu ou à la demande, pour les hommes cisgenres et les personnes trans ayant des rapports anaux, sont explicités. De même que les modalités d’arrêt et de reprise de la PrEP qui sont autant de circonstances possibles de contamination VIH.
C’est sans doute de la PrEP par le cabotégravir injectable qu’est venue la plus grande surprise. Certes, le calendrier était compliqué, l’AMM du Cabotegravir en PrEP étant sorti au moment du bouclage de ces recommandations. Mais la fiche de synthèse introduit un concept, inédit à notre connaissance, celle de PrEP de «première intention (TDF/FTC)» et la PrEP de «seconde intention (CAB-LP)»: «La PrEP orale par ténofovir disoproxil fumarate/emtricitabine (TDF/FTC) est le traitement de 1ʳᵉ intention. Elle est habituellement très bien tolérée»; «La PrEP par cabotégravir d’action prolongée (CAB-LP) par voie injectable est une alternative en 2ᵉ intention».
En analysant les 3 documents, on suit le glissement sémantique. Dans l’argumentaire (89 pages), il n’est pas fait état de hiérarchisation du type de PrEP en 1ʳᵉ et 2ᵉ intention:
- «Plus récemment, l’utilisation du cabotégravir d’action prolongée (CAB-LP) par voie intramusculaire en PrEP a démontré une excellente efficacité, et cette nouvelle forme de PrEP est recommandée par l’Organisation mondiale de la Santé (OMS). Ces études ont montré à la fois un très bon niveau de sécurité d’utilisation et une excellente efficacité préventive, sous réserve d’une bonne observance», page 10;
- «La PrEP par cabotégravir d’action prolongée (CAB-LP) par voie IM tous les 2 mois constitue une offre supplémentaire de prévention pour pallier les limites d’utilisation de la PrEP par TDF/FTC, notamment chez les individus ayant une contre-indication ou une observanceObservance L’observance thérapeutique correspond au strict respect des prescriptions et des recommandations formulées par le médecin prescripteur tout au long d’un traitement, essentiel dans le cas du traitement anti-vih. (On parle aussi d'adhésion ou d'adhérence.) compromise à la PrEP orale.» page 11.
Les justifications seraient donc les suivantes :
- «La PrEP par CAB-LP injectable peut être proposée en alternative en cas de contre-indication à la PrEP par TDF/FTC (notamment insuffisance rénale) ou quand la PrEP orale ne peut être utilisée dans de bonnes conditions. Cependant, compte tenu du risque de sélection de virus résistants aux INIINI Les inhibiteurs de l’intégrase, ou anti-intégrases sont l'une des dernières classes d’antirétroviraux. Ils agissent en empêchant le VIH d’intégrer son message génétique dans celui de la cellule cible. Ces médicaments ont un profil de résistances différent des autres molécules, ce qui les rend intéressants en cas de multi-résistances face aux autres traitements. en cas d’échec, des difficultés du diagnostic en cas d’infection incidente, et de la différence de coût (NDR : le prix n’est pas encore fixé en France) de traitement entre CAB-LP et TDF/FTC en 2024, la PrEP injectable reste une indication de seconde intention», page 22.
Contrairement à l’avis de la Commission de transparence daté du 29 mai 2024 de la même HAS, qui décrivait la PrEP injectable comme un outil alternatif, est introduit ici une notion de hiérarchisation. Selon nos informations, ces recommandations sont susceptibles d’évoluer en fonction des progrès de la science, dont l’arrivée future du Lenacapavir et ses «100% d’efficacité» chez les femmes cisgenres en Afrique du Sud.
Des charges virales régulières sont recommandées pour surveiller l’efficacité.A M1 puis tous les deux mois jusqu’à la 5ᵉ injection puis tous les 4 mois. Les seules contre-indications à la PrEP par TDF/FTC sont la présence d’une infection VIH ou d’une insuffisance rénale avec DFG <50 mL/min/1,73m.
Nouvelles indications pour le TPETPE Traitement (ou prophylaxie) post-exposition. Consiste à prescrire à une personne exposée à l'infection par le VIH, lors d’un accident d’exposition professionnel ou sexuel, une multithérapie d'antirétroviraux, de préférence dans les 4h qui suivent l'accident.
Un rappel ne fait jamais de mal: Le Traitement post exposition associe trois molécules antirétrovirales pendant une durée de 30 jours et peut être proposé aux personnes qui ont été possiblement exposées au VIH. Il doit être instauré le plus tôt possible, idéalement dans les 4 h après l’exposition. Il n’est efficace que s’il est débuté dans les 48h suivant l’exposition.
C’est désormais l’utilisation de l’association doravirine/ténofovir-disoproxil/lamivudine qui est recommandée en 1ʳᵉ intention, puisqu’elle répond aux critères de coût, de tolérance et d’efficacité: ténofovir-disoproxil (TDF) (245 mg), lamivudine (3TC) (300 mg) ou emtricitabine (FTC) (200 mg) et doravirine (DOR) (100 mg):
- «Soit comprimé unique quotidien de TDF/3TC/DOR (245/300/100 mg). Cette option combine l’avantage du comprimé unique et d’un coût réduit.
- Soit 2 comprimés en une prise quotidienne de TDF/FTC (245/200 mg) et DOR (100 mg). Cette option a l’avantage d’un coût encore plus bas que le comprimé unique. Quand cela est souhaité, elle permet d’enchainer sur la PrEP par TDF/FTC en supprimant simplement le comprimé de DOR.»
A noter que ces recommandations très claires insistent sur le fait que la PrEP peut être débutée immédiatement après un TPE, si le niveau d’exposition le justifie et si la personne le souhaite. Dans cette situation, une sérologieSérologie Étude des sérums pour déterminer la présence d’anticorps dirigés contre des antigènes. VIH est prélevée à la fin du TPE, la PrEP est débutée le lendemain, et la sérologie est contrôlée comme dans tout suivi PrEP à M1. (Voir notre article : Le traitement post-exposition dans la prévention combinée, pas seulement une réponse à un accident ponctuel.)

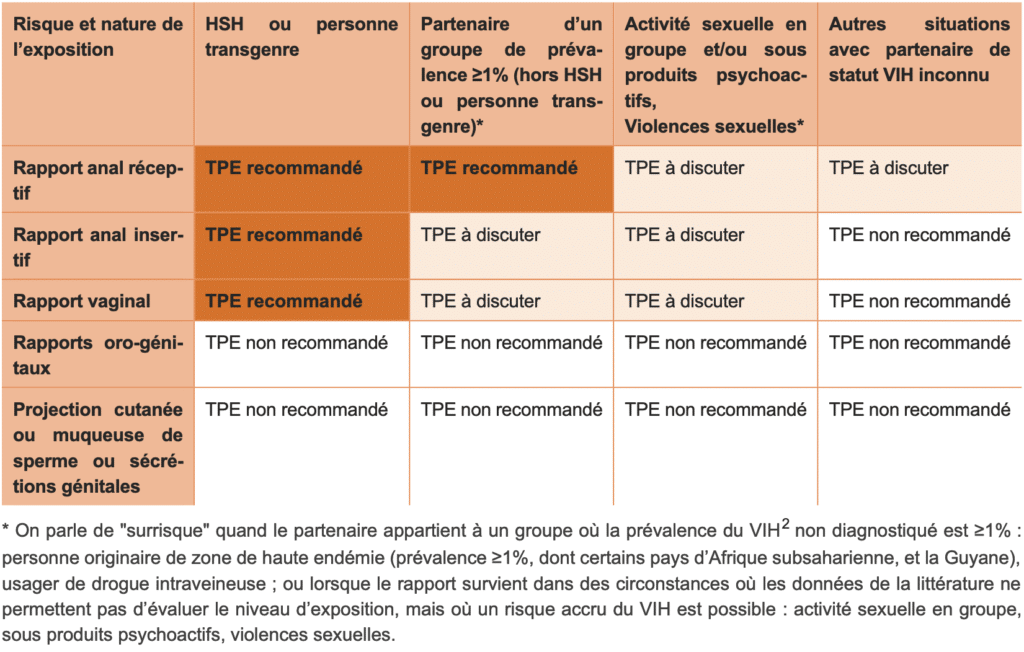
Concernant les indications, les recommandations adoptent un modèle similaire à celui des recommandations britanniques. S’il reste à discuter au cas par cas, le traitement est recommandé si, statistiquement, le nombre de personnes à traiter pour éviter une infection dans ce type d’exposition est inférieur à 10000. Entre 10000 et 100000, le traitement est à discuter, et au-delà de 100000, il n’est pas recommandé.
Ainsi, le TPE n’est plus recommandé par défaut en cas de rapports oraux-génitaux non protégés. Il le reste en cas de fellation réceptive avec charge viraleCharge virale La charge virale plasmatique est le nombre de particules virales contenues dans un échantillon de sang ou autre contenant (salive, LCR, sperme..). Pour le VIH, la charge virale est utilisée comme marqueur afin de suivre la progression de la maladie et mesurer l’efficacité des traitements. Le niveau de charge virale, mais plus encore le taux de CD4, participent à la décision de traitement par les antirétroviraux. >1000 copies/mL documentée chez le partenaire source.
Le TPE est particulièrement indiqué dans les cas de risque élevé, comme les rapports anaux non protégés avec des hommes ayant des relations sexuelles avec des hommes (HSH) ou des femmes transgenres dont le statut VIH est inconnu. Les auteurs introduisent la notion de surrisque: «On parle de « surrisque » quand le partenaire appartient à un groupe où la prévalencePrévalence Nombre de personnes atteintes par une infection ou autre maladie donnée dans une population déterminée. du VIH1 non diagnostiqué est ≥1%: personne originaire de zone de haute endémie (prévalence ≥1%, dont certains pays d’Afrique subsaharienne, et la Guyane), usager de drogue intraveineuse; ou lorsque le rapport survient dans des circonstances où les données de la littérature ne permettent pas d’évaluer le niveau d’exposition, mais où un risque accru du VIH est possible: sexe en groupe, sexe sous produits psychoactifs, violences sexuelles.»
Toutes les personnes présumées exposées doivent bénéficier d’un bilan initial. En l’absence d’indication à un TPE, ce bilan initial se limite à la recherche du VIH et des hépatites et des IST bactériennes en cas d’exposition sexuelle. La doxycycline en prévention des IST bactériennes (DoxyPEP) n’est toujours pas recommandée après un accident d’exposition sexuelle.
En l’absence de TPE et de risque d’hépatite, le contrôle de la sérologie VIH et des IST se fera à 6 semaines de l’exposition. En cas de TPE, mais sans que l’on ait retenu l’indication de PrEP, et toujours sans risque d’hépatite, le bilan VIH et IST sera réalisé à 10 semaines de l’exposition (6 semaines après la fin du traitement). En cas de risque d’hépatite, les contrôles seront réalisés à 12 semaines, afin de ne pas méconnaître l’apparition tardive des marqueurs du VHB et du VHC. Notons que ce schéma 4-6-10-12 semaines n’est simple, ni pour le clinicien, ni pour le patient.
Les nouvelles recommandations préconisent que les kits de démarrage du TPE soient accessibles en pharmacie d’officine, sans consultation médicale préalable, sur le modèle du dispositif actuel de délivrance de la contraception orale d’urgence, et qu’il puisse être délivré par des acteurs de proximité, sur le modèle de la pratique des TRODs.
Il est aussi recommandé que l’autorisation de prescrire le TPE soit étendue à tous les médecins, comme pour la PrEP, à toutes les sage-femmes et que tous les centres de santé sexuels délivrent les kits et prescrivent le TPE.
Enfin, il est recommandé que la possibilité de délivrer un TPE aux mineurs sans consentement parental soit clairement établie, au moins pour les services d’urgences, les CeGIDDCeGIDD Centre gratuit d’information, de dépistage et de diagnostic (CeGIDD) des infections par les virus de l'immunodéficience humaine, des hépatites virales et des infections sexuellement transmissibles. Ces centres remplacent les Centres de dépistage anonyme et gratuit (CDAG) depuis le 1er janvier 2016. les centres de santé sexuelle et les services hospitaliers spécialisés et en toute confidentialité.
Les nouvelles recommandations soulignent l’importance d’utiliser le TPE comme une porte d’entrée vers la PrEP. Il est conseillé de discuter de la PrEP avec toute personne se présentant pour un TPE, et de passer directement à une PrEP après le TPE si la situation de la personne montre que cette exposition peut être répétée. Les personnes pour lesquelles on propose une prescription de PrEP à l’issue du TPE feront un bilan biologique à 4 semaines de l’exposition, à la fin du traitement, permettant d’enchaîner directement les deux traitements.
Pour celles et ceux qui veulent bénéficier d’une formation professionnelle spécifique (avec ou sans numéro RPPS) il existe toujours le e-learning sous l’égide, entre autres, de la Direction générale de la santé (DGS) et de la Société française de lutte contre le sidaSida Syndrome d’immunodéficience acquise. En anglais, AIDS, acquired immuno-deficiency syndrome. (SFLS): https://www.formaprep.org/, et https://www.formasantesexuelle.fr/ qui comprend 4 parcours: IST, Santé Sexuelle, Santé reproductive et Réseaux d’orientation.
