L’équipe autour d’Andrew Phillips a déjà modélisé en 2015 (1) l’infection VIHVIH Virus de l’immunodéficience humaine. En anglais : HIV (Human Immunodeficiency Virus). Isolé en 1983 à l’institut pasteur de paris; découverte récemment (2008) récompensée par le prix Nobel de médecine décerné à Luc montagnier et à Françoise Barré-Sinoussi. en évaluant entre autres ce qu’il faudrait pour que 90% des HSHHSH Homme ayant des rapports sexuels avec d'autres hommes. séropositifs soient en charge viraleCharge virale La charge virale plasmatique est le nombre de particules virales contenues dans un échantillon de sang ou autre contenant (salive, LCR, sperme..). Pour le VIH, la charge virale est utilisée comme marqueur afin de suivre la progression de la maladie et mesurer l’efficacité des traitements. Le niveau de charge virale, mais plus encore le taux de CD4, participent à la décision de traitement par les antirétroviraux. indétectable : si 90% des hommes nouvellement infectés étaient dépistés positifs l’année de leur infection, l’effet TASPTasp «Treatement as Prevention», le traitement comme prévention. La base du Tasp a été établie en 2000 avec la publication de l’étude Quinn dans le New England Journal of Medicine, portant sur une cohorte de couples hétérosexuels sérodifférents en Ouganda, qui conclut que «la charge virale est le prédicteur majeur du risque de transmission hétérosexuel du VIH1 et que la transmission est rare chez les personnes chez lesquelles le niveau de charge virale est inférieur à 1 500 copies/mL». Cette observation a été, avec d’autres, traduite en conseil préventif par la Commission suisse du sida, le fameux «Swiss statement». En France en 2010, 86 % des personnes prises en charge ont une CV indétectable, et 94 % une CV de moins de 500 copies. Ce ne sont pas tant les personnes séropositives dépistées et traitées qui transmettent le VIH mais eux et celles qui ignorent leur statut ( entre 30 000 et 50 000 en France). jouerait alors à plein. Cet objectif n’a pas été réalisé, mais un recul remarquable du nombre de nouvelles infections a été observé. Les moyens déployés ne suffisent pourtant pas à assurer la réalisation de l’objectif 2030 : moins de 50 nouvelles infections chez les HSH.
Depuis l’introduction des traitements efficaces au milieu des années 1990, l’usage du préservatif a baissé chez les HSH en Angleterre comme ailleurs, mais une offre de prévention combinée, facilement accessible a été mise en place en termes de dispositifs (cliniques de santé sexuelle), d’innovation (tests par autoprélèvement à domicile, PrEP) et gratuité. Même si la PrEPPrEP Prophylaxie Pré-Exposition. La PrEP est une stratégie qui permet à une personne séronégative exposée au VIH d'éliminer le risque d'infection, en prenant, de manière continue ou «à la demande», un traitement anti-rétroviral à base de Truvada®. n’est devenue gratuite pour tous qu’à la mi-2020, l’étude PrEP Impact Trial avait inclus 26 000 personnes (2) et beaucoup s’étaient débrouillés pour obtenir la PrEP par leurs propres moyens.
Les nouveaux diagnostics HSH ont connu entre 2014 et 2021 une baisse très forte, passant de 3214 à 971, et ce, en dépit d’une légère réaugmentation entre 2020 et 2021. En 2021, le nombre de nouvelles infections a été estimé à 620 (IC 390 – 910). En adoptant l’objectif d’élimination pour 2020 à moins de 50 infections par an, le gouvernement britannique a fixé une étape à 2025 de réduction de 80% par rapport à 2019, soit 250 nouvelles infections.
Les effets de la prévention combinée
L’équipe modélisatrice a donc évalué les chances d’atteindre l’objectif en 2030, combinant les moyens de la prévention combinée et d’en évaluer le coût-efficacité à l’horizon 2041. Le plan britannique comporte l’accès équitable aux programmes de prévention ; la montée en charge du dépistage (notamment le circuit postal pour des dépistages sur prélèvements sanguins à domicile) ; l’optimisation de l’accès rapide au traitement pour les personnes diagnostiquées positives et le maintien dans le soin ; l’amélioration de la qualité de vie des PVVIHPVVIH Personne vivant avec le VIH Une mesure supplémentaire de dépistage systématique du VIH et des hépatites B et C en opt-out des consultants prélevés dans le cadre de leur recours aux urgences du National Health Services, a été introduite dans cet objectif.
L’équipe de modélisateurs a utilisé le modèle mis au point dans les études antérieures. Deux analyses ont été menées : la première évalue l’effet propre de chaque intervention (dépistage et traitement, PrEP, utilisation du préservatif) sur l’incidence des infections entre 2012 et 2022 ; la seconde estime la probabilité de réaliser les objectifs de 2025 et 2030 si les interventions restent au même niveau d’intensité, puis estiment cette probabilité si les interventions sont intensifiées. Ces analyses sont assorties d’études coût-efficacité en termes de QALY (Quality Adjusted Life Years : années de vie pondérées par la qualité) dans la situation actuelle et en situation d’intensification des actions, ce qui suppose des coûts annuels supplémentaires.
L’évolution de l’épidémie entre 2012 et 2022 a été modélisée par simulation (pour un échantillon d’une taille équivalant à 4,5% de la population HSH), et en introduisant dans les simulations un grand nombre de paramètres observés au cours des enquêtes ou études successives portant sur les pratiques de prévention, le dépistage, les ISTIST Infections sexuellement transmissibles. le parcours des séropositifs (traitement, charge virale, variation des CD4, décès), les comportements sexuels, les rapports avec des partenaires non résidents, l’augmentation de la population.
Ainsi, les paramètres du modèle de référence rendent compte des évolutions observées :
- Les rapports sans préservatif ont augmenté depuis 1998 au cours du temps ;
- La fréquence du test trimestriel des HSH négatifs a augmenté depuis 2006 ;
- L’initiation immédiate du traitement après le diagnostic d’infection VIH a fortement augmenté à partir de mi-2015 ;
- La PrEP initiée à petite échelle en 2013, étendue à 26 000 personnes pendant le PrEP Impact Trial, puis généralisée et gratuite après les résultats de celle-ci à partir de mi-2020.
Méthode
Pour mesurer les effets propres de chaque méthode de prévention, les hypothèses introduites séparément dans la modélisation sont les suivantes : un arrêt de l’augmentation du dépistage en 2012 ; la non-introduction du traitement immédiat après diagnostic mi-2015 ; la non-introduction de la PrEP et un niveau d’utilisation du préservatif aussi bas qu’avant 1980. Les estimations de l’impact de ces moyens de prévention sont basées sur une efficacité à 100% du préservatif, l’efficacité de l’effet TasP selon la charge virale sur la base des données de l’essai Partner 2 et celle de la PrEP sur les résultats d’efficacité de Proud et Ipergay.
Le modèle a tourné 300 000 fois pour modéliser l’incidence de la période 2012-2022 et les modèles sélectionnés pour les modélisations ultérieures (302) sont ceux qui reproduisent au plus près le déclin de l’incidence entre 2012 et 2022.
Le modèle de référence pour la période 2012-2022 estime une baisse de 77% (IC90% 61-88) des nouvelles infections, baisse qui démarre en 2014, soit 597 infections en 2022 (1,1 pour 1000 personnes années). En 2022, si la PrEP n’avait pas été introduite, le nombre de nouvelles infections aurait été 2,16 fois plus élevé (IC : 1,06-3,75) que celui observé, si le traitement immédiat des nouveaux diagnostiqués n’avait pas été introduit, ce nombre serait 2,18 fois plus élevé (IC 1,18-3.60). Sans ces deux interventions majeures, le nombre de nouvelles infections serait 3,64 fois plus élevé (IC 1,67-6,55). Si les rapports non protégés par le préservatif étaient restés à leur niveau pré-épidémie, le nombre de nouvelles infections sur la période aurait été 2,27 (0,9-5,4) fois plus élevé que l’observé.
Mais les modélisateurs vont plus loin et modélisent le cours de l’épidémie si les interventions se maintiennent dans le temps au même niveau qu’en 2022 : le verdict est sans appel, l’objectif de 50 nouvelles infections chez les HSH en 2030 n’a aucune chance d’être atteint, on en serait à 388 (IC 226-650) en 2025 (au lieu des 250 visés) et à 263 (IC 137-443) en 2030.
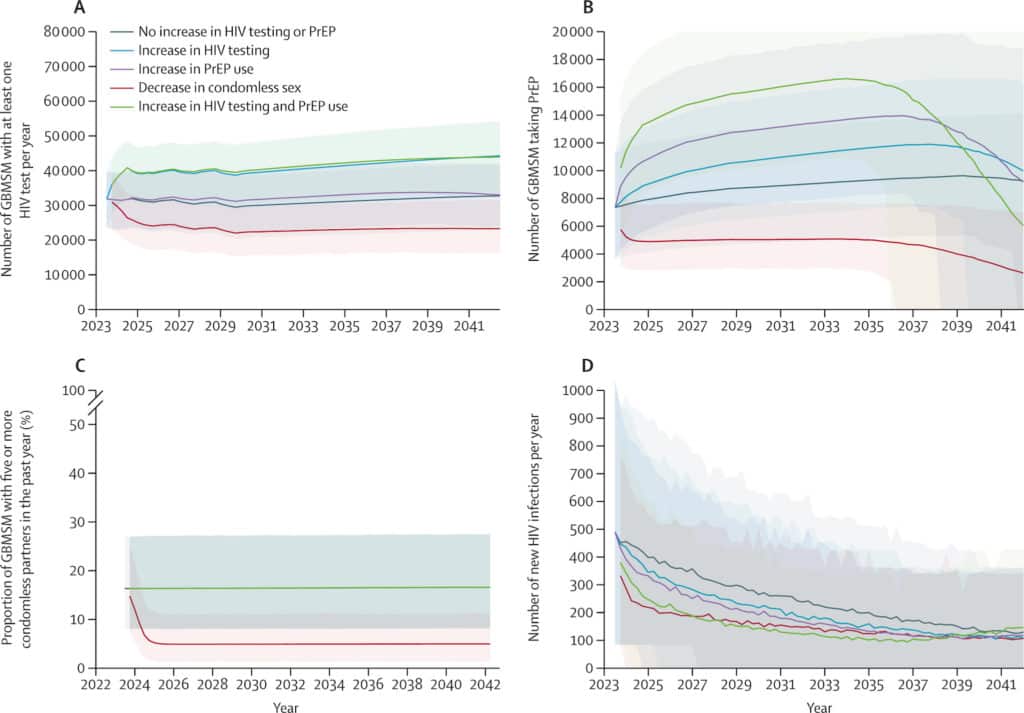
(Les lignes représentent les médianes des exécutions du modèle, l’ombrage représente l’intervalle d’incertitude de 90 %.)
Noir : Pas d’augmentation du dépistage du VIH ou de la PrEP, Bleu : Augmentation du dépistage du VIH
Violet : Augmentation de l’utilisation de la PrEP, Rouge : Diminution des relations sexuelles sans préservatif
Vert : Augmentation du dépistage du VIH et de l’utilisation de la PrEP
Des moyens de s’en sortir…
Face à ce constat, ils estiment l’effet d’une intensification des interventions – augmentation du dépistage, augmentation de la PrEP, baisse des rapports non protégés – qui diminueraient chacune le nombre de nouvelles infections de 15% à 36%. Mais même en combinant une augmentation de la PrEP et du dépistage, l’objectif 2025 a 76% de chance d’être atteint et celui de 2030, quasiment aucune
Les barrières à l’intensification des interventions sont identifiées ici du côté de l’offre trop réduite (non-réponse des services, longs délais d’attente pour la PrEP notamment) et d’autres barrières à l’accès, notamment le stigma. L’étude coût-efficacité montre que les augmentations nécessaires pour étendre les offres avec les modalités actuelles de dépistage et de PrEP atteignent des niveaux de coût qui ne les rendent pas coût-efficaces. Il faut donc baisser leur coût. C’est pourquoi, en conclusion, les auteurs suggèrent, pour parvenir à une efficience augmentée de la dépense publique, de déployer des méthodes moins coûteuses et particulièrement de développer l’autotest (en Angleterre, plutôt un service en ligne avec envoi de kits d’autoprélèvement qui existe déjà à large échelle) et la PrEP à la demande.
Ces modélisations puissantes, fortement documentées, viennent ébranler la perspective de l’élimination de l’infection VIH malgré les moyens puissants que sont la fiabilité et la diversité du dépistage, l’efficacité préventive du traitement et celle de la PrEP, efficacité qui est sans égales dans bien des domaines de la médecine. Cet exercice de modélisation est bienvenu pour prendre la mesure des possibles, des exigences d’objectifs ambitieux quand ils sont pris au sérieux : alors devons-nous rester dans le slogan, faire reluire l’utopie, revenir à plus l’humilité face à la pandémie VIH ou inventer et inventer encore ?
Ref : Cambiano V, Miners A, Lampe FC, McCormack S, Gill ON, Hart G, Fenton KA, Cairns G, Thompson M, Delpech V, Rodger AJ, Phillips AN. The effect of combination prevention strategies on HIV incidence among gay and bisexual men who have sex with men in the UK: a model-based analysis. Lancet HIV. 2023 Nov;10(11):e713-e722. doi: 10.1016/S2352-3018(23)00204-7. Erratum in: Lancet
HIV. 2023 Nov 20;: PMID: 37923485.
- Phillips AN, Cambiano V, Miners A, Lampe FC, Rodger A, Nakagawa F, Brown A,
Gill ON, De Angelis D, Elford J, Hart G, Johnson AM, Lundgren JD, Collins S, Delpech V. Potential impact on HIV incidence of higher HIV testing rates and earlier antiretroviral therapy initiation in MSM. AIDS. 2015 Sep10;29(14):1855-62. doi: 10.1097/QAD.0000000000000767. PMID: 26372391; PMCID:PMC5515630.
↩︎ - Sullivan AK, Saunders J, Desai M, Cartier A, Mitchell HD, Jaffer S, Ogaz D, Chiavenna C, Charlett A, Diamente V, Golombek R, Manavi K, Priestley C, Waters LJ, Milinkovic A, McOwan A, Estcourt C, Sabin CA, Rodger A, Gold D, Gazzard BG, McCormack S, Gill ON; Impact Study Group. HIV pre-exposure prophylaxis and its implementation in the PrEP Impact Trial in England: a pragmatic health technology assessment. Lancet HIV. 2023 Dec;10(12):e790-e806. doi: 10.1016/S2352-3018(23)00256-4. PMID: 38040478. ↩︎
