Les papillomavirus humains, qu’on appelle aussi HPV (Human Papillomavirus) ou VPH (virus du papillome humain) sont un ensemble de virus à ADN de la famille des Papillomaviridae. Il en existe plus de 200 types, classés en fonction de leur tropisme et de leur pouvoir pathogène. Le spectre des maladies associées à HPV, les plus fréquentes des ISTIST Infections sexuellement transmissibles. est très large allant des verrues génitales (condylomes) à plusieurs formes de cancers. Tous sont en rapport avec une transmission sexuelle du HPV mais surtout à la transmission de certains sérotypes considérés comme oncogènes.
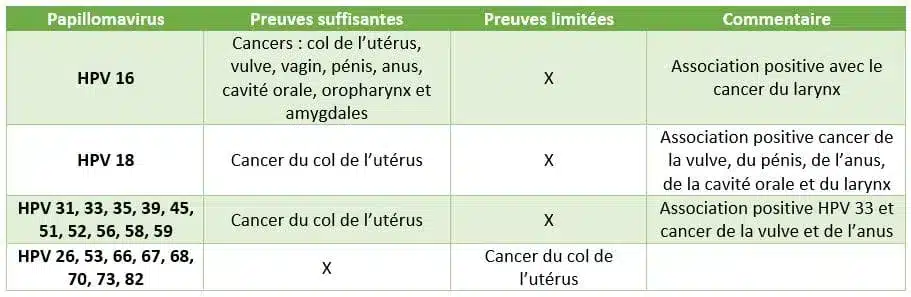
La grande majorité des hommes et des femmes ont été infectés par des papillomavirus au cours de leur vie, généralement dans les premières années suivant le début de l’activité sexuelle. Les infections par les HPV sont le plus souvent inapparentes et disparaissent spontanément, mais dans certains cas, l’infection persiste et peut engendrer des pathologies plus graves. On distingue d’une part les papillomavirus à haut risque oncogène (principalement, HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 et 59), en particulier le type 16 qui est responsable de la plupart des cancers HPV induits chez l’homme, et d’autre part les papillomavirus à faible risque oncogène, essentiellement les types 6 et 11.
Des cancers variés
Globalement, environ 90% des cas de maladies HPV induites sont liés à des types de HPV ciblés par les vaccins existants. Chaque année en France, plus de 6000 nouveaux cas de cancers sont causés par les papillomavirus, et approximativement la moitié de ces cas sont des cancers du col de l’utérus. Au total, un quart de tous les cancers HPV induits surviennent chez l’homme et les plus fréquents sont les cancers de la sphère ORL, puis les cancers de l’anus et les cancers du pénis. L’évolution de l’incidence des cancers HPV induits est compatible avec l’hypothèse d’une augmentation de l’exposition aux HPV à haut risque oncogène résultant de modifications dans les comportements sexuels à partir des années 1960-1970.
Les cancers de la sphère ORL induits par les papillomavirus sont pour la plupart des cancers de l’oropharynx. La particularité de ces cancers par rapport aux autres cancers HPV induits, c’est qu’il n’y a pas de lésions précancéreuses observables au niveau de l’oropharynx. Les cancers de l’anus sont plus fréquents chez la femme que chez l’homme. Chez l’homme, les taux d’incidence sont plus élevés chez les hommes ayant des relations sexuelles avec des hommes (HSH), en particulier chez ceux qui sont séropositifs au VIHVIH Virus de l’immunodéficience humaine. En anglais : HIV (Human Immunodeficiency Virus). Isolé en 1983 à l’institut pasteur de paris; découverte récemment (2008) récompensée par le prix Nobel de médecine décerné à Luc montagnier et à Françoise Barré-Sinoussi.
HPV et VIH
La problématique globale des lésions HPV a fortiori chez les personnes vivant avec le VIH, plus à risques, est multiple et peut être résumée ainsi :
1) le dépistage est parfaitement codifié pour ce qui concerne le cancer du col de l’utérus et les modalités viennent d’en être modifiées en 2020, avec un test PCRPCR "Polymerase Chain Reaction" en anglais ou réaction en chaîne par polymérase en français. Il s'agit d'une méthode de biologie moléculaire d'amplification d'ADN in vitro (concentration et amplification génique par réaction de polymérisation en chaîne), utilisée dans les tests de dépistage. de première intention chez toutes les femmes entre 25 et 65 ans. Il n’existe pas pour les lésions ORL, faute de consensus et surtout de lésions pré-cancéreuses comme pour le col ou l’anus. Enfin, et c’est l’objet de cette mise au point, les recommandations pour les lésions anales sont en train de se préciser et concernent tout particulièrement les hommes et femmes vivant avec le VIH, mais cela bute sur un certain nombre de freins (mauvaise information des médecins, manque de spécialistes formés, achat du matériel d’anuscopie haute résolution, non-valorisation de l’acte…)
2) le HPV augmente le risque de contamination par le VIH en l’absence d’outil de prévention et le VIH favorise le portage et la transformation cancéreuse des lésions HPV. Plusieurs explications à ce dernier point : persistance du virus, diminution de l’élimination virale, réactivation d’une infection latente favorisée par l’immunodépression. Donc la prévalencePrévalence Nombre de personnes atteintes par une infection ou autre maladie donnée dans une population déterminée. est plus élevée à comportement égal : 2 à 4 fois plus d’infection à HPV. Qui plus est, on observe chez les PVVIHPVVIH Personne vivant avec le VIH une augmentation de la fréquence des HPV 16 et 18, les plus oncogènes, en rapport avec une exposition accrue aux HPV et aussi à un dysfonctionnement des cellules B, des cellules T et des cellules NK (natural killer) associé à inflammation persistante.
3) les dysplasies du col ou du canal anal dues à certains HPV sont plus souvent observées chez les PVVIH avec une insuffisance de dépistage. La population infectée par le VIH a un risque 29 fois plus élevé que la population générale de développer un carcinome épidermoïde du canal anal. Ce risque est multiplié par 100 dans la population homosexuelle masculine (HSH) infectée par le VIH. Et le dépistage du cancer anal chez les patient(e)s séropositif(ve)s figure dans les Recommandations nationales du groupe d’experts sur la prise en charge de l’infection par le VIH en France depuis 2010.
4) Le traitement des lésions des néoplasies anales intra-épithéliales est encore mal codifié.
5) la couverture vaccinale est insuffisante en France où le vaccino-scepticisme va bon train, amplifié par la crise CovidCovid-19 Une maladie à coronavirus, parfois désignée covid (d'après l'acronyme anglais de coronavirus disease) est une maladie causée par un coronavirus (CoV). L'expression peut faire référence aux maladies suivantes : le syndrome respiratoire aigu sévère (SRAS) causé par le virus SARS-CoV, le syndrome respiratoire du Moyen-Orient (MERS) causé par le virus MERS-CoV, la maladie à coronavirus 2019 (Covid-19) causée par le virus SARS-CoV-2. qui a de plus réduit le nombre de dépistages et de vaccinations. Pour fixer l’ampleur du problème, la France était classée dans les derniers pays d’Europe, à la 28e place, juste devant la Bulgarie (31), l’Arménie (30) et le Kazakhstan (29)… avec une couverture vaccinale de 24 % (chiffres de 2019) (Paolo Bonanni et al. Expert Review of Vaccines, 2020; 19:11, 1073-1083). Des mesures récentes devraient inciter à la vaccination plus large, notamment la vaccination remboursée chez les garçons et la proposition de vaccination dans les collèges en cette rentrée 2023.
Les cancers anaux induits par le HPV ont une histoire naturelle lente : le développement de ces cancers à partir d’une infection par le HPV peut prendre un certain temps, ce qui souligne l’importance d’un dépistage régulier pour une détection précoce.
Outils de détection des lésions précancéreuses HPV induites
- le frottis anal
- la cytologie anale
- la recherche d’HPV 16 (ou HPV –HR) par PCR
- l’anuscopie de haute résolution (AHR)
Frottis anal pour cytologie anale
Le frottis anal est réalisé avant l’examen clinique et avant l’utilisation d’un lubrifiant. Il est réalisé à l’aide d’un petit écouvillon introduit dans l’anus et retiré tout en frottant doucement les parois de l’anus. Les cellules retirées sont conservées dans une solution liquide adaptée jusqu’à l’arrivée au laboratoire où les cellules sont étalées sur une lame et colorées avant lecture au microscope. Les résultats du frottis sont exprimés selon une classification internationale commune aux frottis du col de l’utérus.
• ASCUS : anomalies mineures de significations indéterminées
• LSIL : anomalies de bas grade
• HSIL : anomalies de haut grade
• ASC-H : anomalies de significations indéterminées mais ne pouvant exclure une lésion de haut grade.
Les frottis HSIL et ASC-H sont très souvent témoins de la présence de lésion de haut grade et sont une indication forte d’anuscopie haute résolution qui permet bien souvent de localiser la ou les lésions de haut grade si elle(s) n’est ou ne sont pas visible(s) à l’œil nu.
Pour plus d’information
Populations exposées aux cancers anaux liés au HPV
Certaines populations sont plus exposées aux cancers anaux liés aux HPV. L’étude de Clifford et al. publiée dans Cancer Epidemiology en 2020, évalue l’incidence du cancer anal dans différents groupes à risque. L’objectif de l’étude était de fournir une échelle unifiée du risque associé au cancer anal, basée sur une méta-analyse complète.
L’incidence du cancer anal est plus élevée chez certains groupes de population, notamment les personnes vivant avec le VIH (PVVIH), les hommes ayant des relations sexuelles avec des hommes (HSH), les femmes diagnostiquées avec des lésions précancéreuses gynécologiques liées au papillomavirus humain (HPV), les receveurs de greffes d’organes solides (RGT) et les patients atteints de maladies auto-immunes.
Les taux d’incidence (TI) du cancer anal, calculés par méta-analyse à effets fixes, étaient de 85 (intervalle de confiance à 95% [IC] = 82-89) pour les HSHHSH Homme ayant des rapports sexuels avec d'autres hommes. séropositifs (n = 7 études; 2 229 234 personnes-années), 32 (IC 95% = 30-35) pour les hommes PVVIH non-HSH (n = 5; 1 626 448 personnes-années) et 22 (IC 95% = 19-24) pour les femmes PVVIH (n = 6; 1 472 123 personnes-années).
Les TI du cancer anal étaient nettement plus élevés après le diagnostic de cancer de la vulve (TI = 48 [IC 95% = 38-61]; n = 4; 145 147 personnes-années) que de cancer du col de l’utérus (9 [IC 95% = 8-12]; n = 4; 779 098 personnes-années) ou de cancer du vagin (TI = 10 [IC 95% = 3-30]; n = 4; 32 671 personnes-années).
Les TI du cancer anal étaient de 10 (IC 95% = 5-19), 6 (IC 95% = 3-11) et 3 (IC 95% = 2-4) pour le lupus érythémateux systémique, la colite ulcéreuse et la maladie de Crohn, respectivement.
Comment améliorer le dépistage ?
Un dépistage ne s’entend que chez des personnes sans symptômes. Le dépistage du cancer de l’anus n’est pas le dépistage du cancer colorectal et ne remplace pas le test FIT (dosage de l’hémoglobine dans les selles par la méthode immunologique), de 50 à 75 ans tous les 2 ans, ou la coloscopie en cas d’antécédents familiaux de cancer colorectal.
Un nouvel algorithme de dépistage est proposé selon le Dr Elisabeth Etienney, l’une des meilleures spécialistes françaises. Basé sur un “triage” des patients et une anuscopie de haute résolution en cas d’anomalie cytologique observée au frottis, il a été présenté aux Journées de la Société nationale française de colo-proctologie le 18 novembre 2022 et il est en cours d’intégration aux recommandations de prise en charge des personnes vivant avec le VIH :
- PCR HPV 16
- Clinique
- Et analyse d’un frottis anal pour cytologie
Les freins à la mise en place sont nombreux :
- La recherche HPV 16 est non remboursée dans cette indication
- La cytologie anale n’est pas réalisée par tous les laboratoires
- Le nombre de centres pratiquant l’anuscopie de haute résolution est encore réduit (une formation existe en France) et très peu d’experts en proctologie y sont formés.
Le passage de l’infection à HPV aux lésions précancéreuses et au cancer
L’apparition du carcinome épidermoïde invasif de l’anus est précédée par le développement de lésions précancéreuses. Ces lésions sont limitées à l’épithélium et ne franchissent pas la membrane basale. Leur diagnostic est histologique et répond à la classification de LAST (Lower Anogenital Squamous Terminology). On distingue les lésions malpighiennes intraépithéliales de bas grade appelées LSIL pour Low Grade Squamous Intraepithelial Lesion et les lésions de haut grade appelées HSIL pour High Grade Squamous Intraepithelial Lesion.
Le taux d’évolution des HSIL vers le cancer invasif est variable au sein même des populations à risque. Les données de la littérature sont hétérogènes. Dans la cohorte française AIN3, ce taux d’évolution vers le cancer était de 1,16 pour 100 patients-années. Cependant cette évolution n’est pas univoque. Une clairance spontanée des HSIL est possible. Elle concernerait, chez les hommes à risque, plus de 20 % des patients par an. La présence d’HPV16, l’âge, la taille des HSIL ou encore l’immunosuppression sont parmi les facteurs qui influencent l’évolution des HSIL. Bien qu’imparfaitement comprise, l’histoire naturelle des HSIL doit être prise en compte pour le dépistage, le traitement et la surveillance des patients à risque.
La protection par le vaccin
Elle est excellente, en particulier par le vaccin nonavalent, Gardasil 9 qui protège contre les HPV 6, 11, 16, 18, 31, 33, 45, 52 et 58. Il est sûr et efficace pour prévenir l’infection oncogénique par le HPV. Le vaccin est remboursé chez les HSH jusqu’à l’âge de 26 ans. Cette limite du remboursement n’empêche pas la prescription, d’autant que le vaccin a montré une forte immunogénicitéImmunogénicité Capacité à produire une réponse immunitaire. chez les hommes d’âge moyen (27 à 45 ans).
Les recommandations nationales de vaccination 2023 indiquent :
• Pour les filles et les garçons :
- Entre 11 et 14 ans révolus : deux doses espacées de 6 à 13 mois.
- Entre 15 ans et 19 ans révolus : trois doses administrées selon un schéma 0, 2 et 6 mois.
• Pour les hommes ayant des relations sexuelles avec des hommes (HSH), la vaccination HPV par Gardasil 9 est recommandée jusqu’à l’âge de 26 ans, en prévention des lésions précancéreuses anales, des cancers anaux et des condylomes. Dans cette situation, la vaccination peut être proposée dans certains CeGIDDCeGIDD Centre gratuit d’information, de dépistage et de diagnostic (CeGIDD) des infections par les virus de l'immunodéficience humaine, des hépatites virales et des infections sexuellement transmissibles. Ces centres remplacent les Centres de dépistage anonyme et gratuit (CDAG) depuis le 1er janvier 2016. et dans certains centres publics de vaccination. Trois doses sont administrées selon un schéma 0, 2 et 6 mois.
• Pour les personnes immunodéprimées : la vaccination contre le papillomavirus est recommandée chez les garçons comme les filles aux mêmes âges que dans la population générale, avec un rattrapage jusqu’à l’âge de 19 ans révolus. Chez les enfants des deux sexes, candidats à une transplantation d’organe solide, la vaccination peut être initiée dès l’âge de 9 ans conformément à son AMMAMM Autorisation de Mise sur le Marché. Procédure administrative qui autorise un laboratoire pharmaceutique à commercialiser une molécule.
À noter qu’en Angleterre, à partir de septembre 2023, pour les adolescents de 12 à 13 ans, le programme passera d’ailleurs de deux doses à une seule dose, offerte dans les collèges. Même chose pour les HSH de moins de 25 ans, la dose unique sera proposée dans les cliniques de santé sexuelle.
Le cas des prépeurs
Une sous-étude de l’essai Ipergay nous a renseignés sur le statut HPV des personnes sous PrEPPrEP Prophylaxie Pré-Exposition. La PrEP est une stratégie qui permet à une personne séronégative exposée au VIH d'éliminer le risque d'infection, en prenant, de manière continue ou «à la demande», un traitement anti-rétroviral à base de Truvada®.
(Cotte L et al. Clin Infect Dis 2021, 72:41-9) :
Sur les 162 participants inclus dans cette sous-étude de l’essai ANRS-Ipergay, la prévalence de tout génotype de HPV au début de l’essai était respectivement de 92%, 32% et 12% pour les sites anaux, péniens et oraux. Des génotypes de HPV à haut risque (HR) ont été observés dans respectivement 84%, 25% et 10% des échantillons de référence anaux, péniens et oraux. Des génotypes de HPV nonavalents ont été observés respectivement dans 77%, 22% et 6% des échantillons de référence anaux, péniens et oraux.
Des infections multiples ont été observées dans respectivement 76%, 17% et 3% des cas dans les sites anaux, péniens et oraux. Les génotypes à haut risques les plus fréquents étaient les HPV 53, 51 et 16 dans les échantillons anaux, les HPV 33, 39 et 73 dans les échantillons péniens et les HPV 66 dans les échantillons oraux.
L’incidence de tout génotype HPV au niveau anal était de 86,2/1000 mois-personne et l’incidence des génotypes HR-HPV était de 72,3/1000 mois-personne. La cytologie de base était normale dans 32% des cas et a été classée comme cellules malpighiennes atypiques de signification indéterminée, lésion malpighienne intra-épithéliale de bas grade, lésion malpighienne intra-épithéliale de haut grade (HSIL) et cellules malpighiennes atypiques ne permettant pas d’exclure une HSIL dans 23%, 40%, 5% et 1% des cas, respectivement.
Mais souvent une occasion manquée
Dans son étude de 2022, Christopher W. Wheldon met en lumière les opportunités manquées pour la prévention du cancer anal parmi les populations à risque, en Pennsylvanie, notamment les hommes ayant des rapports sexuels avec des hommes (HSH), ainsi que les femmes transgenres ayant des rapports sexuels avec des hommes, deux populations à risque disproportionné de cancer anal.
Les résultats de l’étude montrent que plus de la moitié des HSH et des femmes transgenres prépeuses n’avaient pas encore initié la vaccination contre le HPV. L’acceptabilité du vaccin contre le HPV est pourtant élevée parmi les participantes. La faible utilisation du vaccin contre le HPV est donc probablement due à une mauvaise connaissance et à des occasions manquées lors de la prise en charge médicale, la vaccination contre le HPV n’étant pas incluse dans les directives actuelles de dépistage pour l’initiation de la PrEP.
