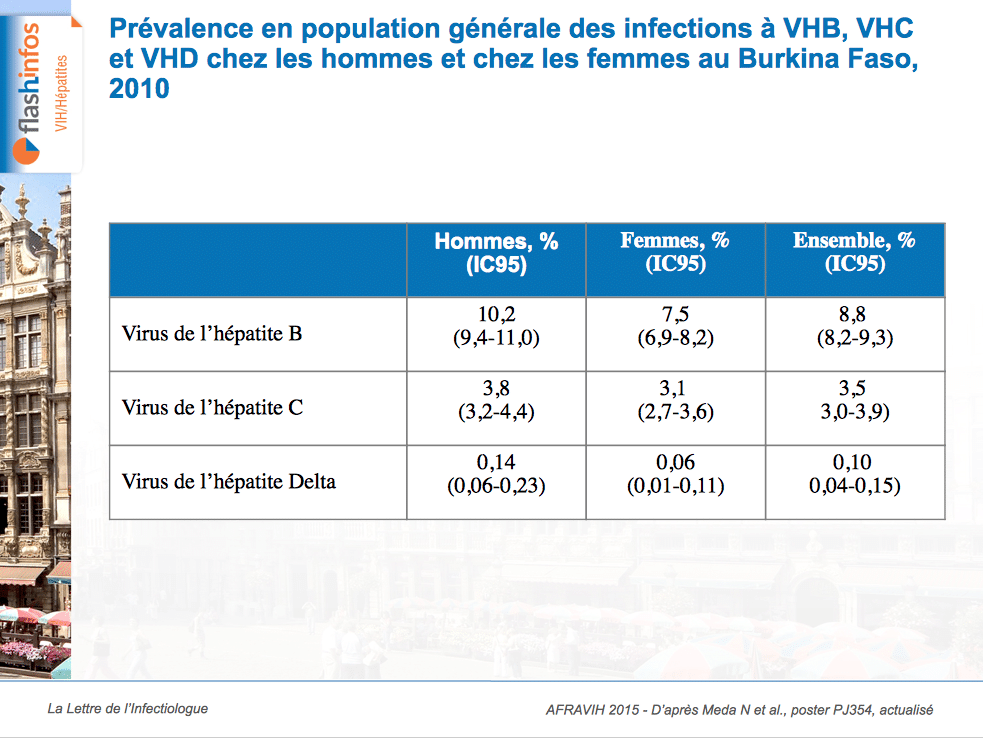
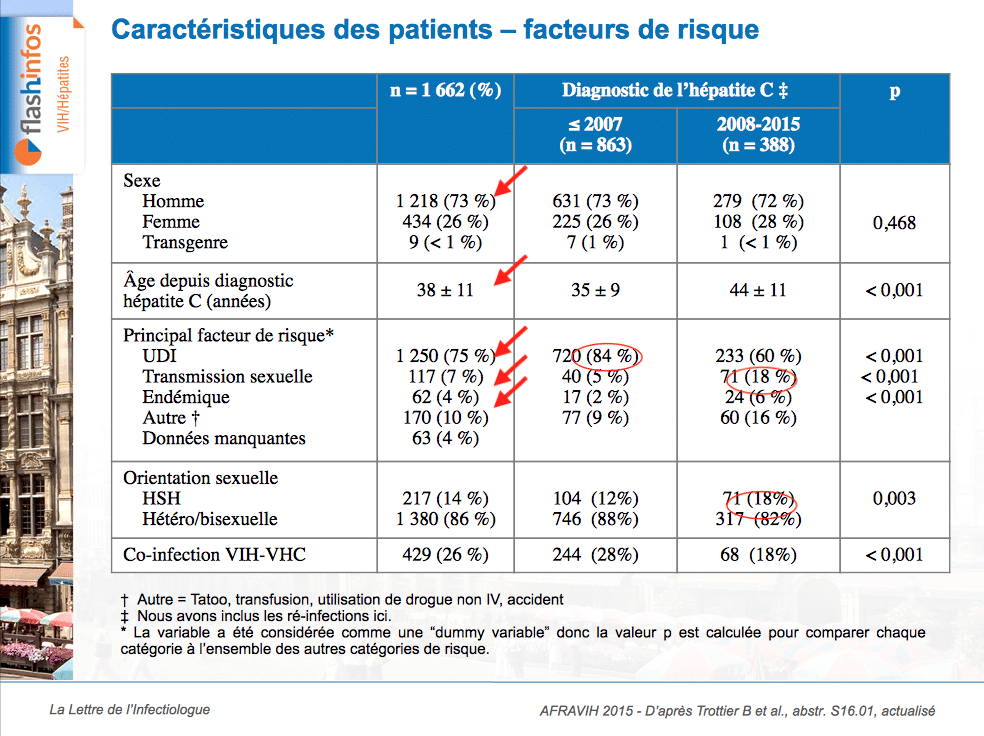
Etude FIBRHIVIET-ANRS 12262 : près d’un quart des co-infectés VIH/VHC au Vietnam ont une fibrose sévère ou une cirrhose
En 2014, une étude transversale a été réalisée parmi les PPVIH sous antirétroviraux suivis à la consultation de l’hôpital Viet Tiep de Haiphong. Les patients présentant une sérologie VHC positive, en succès de traitement ARV (CD4 > 200/mm3), ont été inclus dans l’étude. Une évaluation des caractéristiques démographiques, cliniques, virologiques et une élastométrie (Fibroscan®) ont été réalisés.