Le climat, un déclencheur silencieux
Historiquement, le virus de la FHCC circulait dans les Balkans, en Turquie, en Asie centrale et dans certaines régions d’Afrique. Mais au cours de la dernière décennie, son aire de distribution s’est considérablement élargie, glissant progressivement vers l’Europe occidentale.
Les changements climatiques jouent ici un rôle déterminant : hivers plus doux, printemps précoces et sécheresses prolongées favorisent la survie des tiques adultes et l’extension de leurs zones d’habitat vers le nord. Les oiseaux migrateurs participent également à la dissémination du virus, transportant les tiques infectées depuis l’Afrique du Nord vers le pourtour méditerranéen européen.
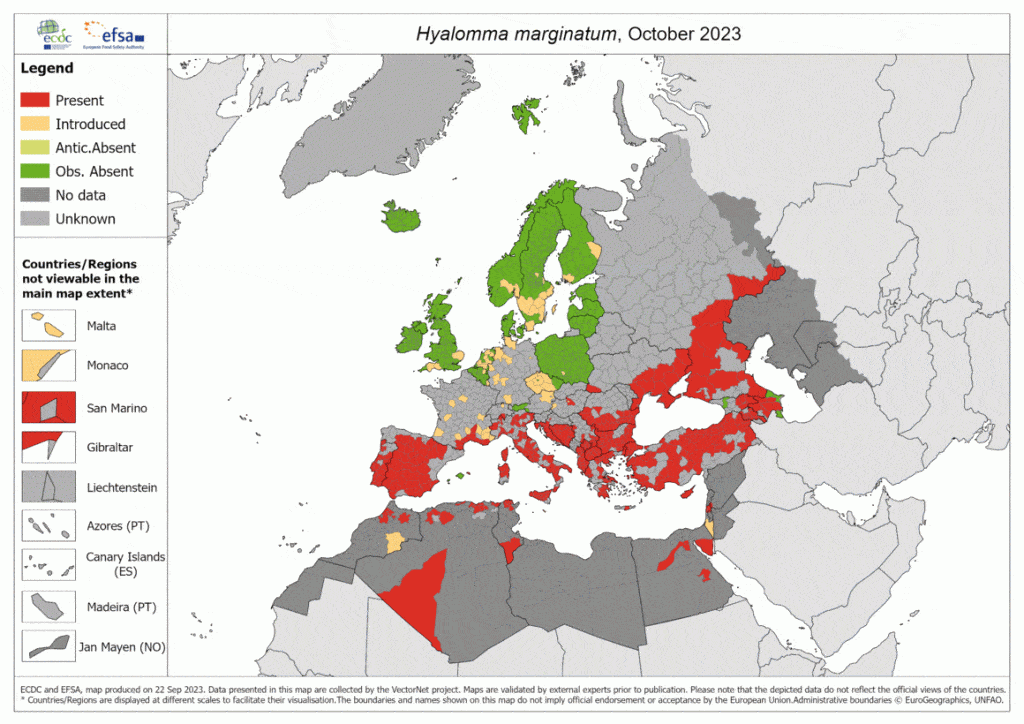
Animation illustrant la distribution de la présence d’Hyalomna marginatum, principal vecteur de la FHCC et des autres tiques vectrices. Source ECDC https://www.ecdc.europa.eu/en/disease-vectors/surveillance-and-disease-data/tick-maps
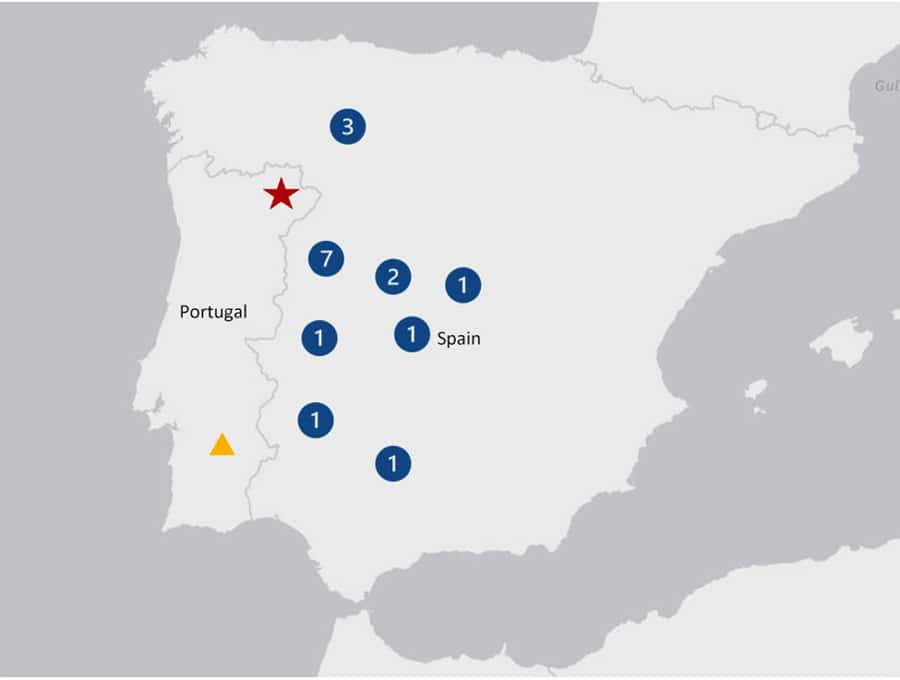
Régions de la péninsule ibérique où des infections humaines par le VFHCC ont été signalées. L’étoile indique un cas mortel de FHCC (Portugal) en 2024 ; le triangle indique les cas séropositifs détectés dans le district de Beja (Portugal) en 1985. Les cercles numérotés indiquent le nombre de cas humains signalés dans les provinces espagnoles depuis 2013. (Salamanca, 7; León, 3; Ávila, 2; Badajoz, 1; Cáceres, 1; Córdoba, 1; Madrid, 1; and Toledo, 1). Source Zé-Zé L. et al. (2025) https://doi.org/10.3201/eid3101.241264
Epidémiologie de la FHCC chez les humains en Europe
Selon l’ECDC, entre 2013 et octobre 2024, 61 infections humaines contractées dans l’UE/EEE ont été notifiées. La majorité a été diagnostiquée en Bulgarie (n = 41), suivie de l’Espagne (n = 17), de la Grèce (n = 1, contractée en Bulgarie), du Royaume-Uni (n = 1, contractée en Bulgarie) et du Portugal (n = 1). Deux cas supplémentaires ont été signalés en Macédoine du Nord en 2023.
Des données de séroprévalence humaine sont disponibles pour des régions spécifiques et à travers le monde. Une revue systématique analysant les études de séroprévalence de la FHCC chez l’homme dans la région européenne de l’OMS, publiée en 2020, a révélé les taux les plus faibles dans les études rapportées en Europe occidentale (0 % en Espagne ; 1,1 % au Portugal), des taux intermédiaires dans certaines régions d’Europe de l’Est (Kazakhstan, 12,7 %) et les taux les plus élevés dans les régions d’Europe centrale (près de 20 % dans une étude d’une région endémique en Turquie). L’étude espagnole incluse dans la revue n’a pas identifié de sérums humains positifs, mais une étude ultérieure a démontré une séroprévalence du VFHCC d’environ 1 % chez des donneurs de sang sains.
Les animaux, un réservoir invisible mais actif
Les animaux participent également activement à la circulation enzootique du virus, mais en silence. Contrairement aux humains, eux ne tombent pas malades ; par conséquent, aucun symptôme n’alerte l’éleveur ou le vétérinaire.
Historiquement endémique dans l’ex-URSS et les Balkans, le VFHCC s’est récemment répandu dans de nouveaux pays européens. Il a été détecté pour la première fois chez des tiques en Espagne en 2010, en provenance probable d’Afrique du Nord, via des oiseaux migrateurs, et sa présence ne cesse de croître dans la péninsule ibérique, avec plusieurs génotypes identifiés. La séroprévalence reste globalement faible chez les petits ruminants en Espagne et au Portugal, mais des foyers plus élevés apparaissent localement (par exemple, 9 % en Corse ou jusqu’à 15 % chez les bovins en Bosnie-Herzégovine). Des génotypes variés ont été détectés, notamment sur différentes espèces de tiques et dans de nouvelles localisations comme le sud de la France et Israël (séroprévalences de 4 à 38 %). Les analyses révèlent une circulation focale et établie du virus, bien que des lacunes subsistent dans la compréhension de son épidémiologie régionale.
Publiée tout récemment, une étude nationale conduite par Célia Bernard (CIRAD, UMR ASTRE, Montpellier, France, ASTRE, Univ Montpellier, CIRAD, INRAE, Montpellier, France, French Establishment for Fighting Zoonoses (ELIZ), Malzéville, France), a fourni les premières données sérologiques de grande ampleur sur le grand Sud de l’Hexagone. Au total, 8 609 échantillons bovins prélevés entre 2018 et 2022 et 2 182 échantillons de faune sauvage (sangliers, cerfs, chevreuils, mouflons) recueillis entre 2008 et 2022 ont été testés par ELISA puis confirmés par un test de neutralisation virale en laboratoire P4. Les résultats sont sans équivoque :
- Globalement, 2 % des bovins testés étaient positifs au virus de la FHCC, avec des variations locales substantielles ;
- Chez la faune sauvage, 2,25 % des animaux testés étaient positifs.
Les foyers les plus marqués ont été identifiés dans les Pyrénées-Orientales (9,09 %) et les Alpes-Maritimes (7,18 %) chez les bovins, ainsi que dans les Hautes-Pyrénées chez les cervidés et sangliers. Ces résultats s’alignent sur des schémas observés en Espagne, autre pays européen concerné par la circulation de ce virus. Pour Célia Bernard, première autrice de l’étude, « ces données révèlent l’existence de cycles de transmission enzootiques impliquant tiques locales et hôtes animaux, même en l’absence de cas humains déclarés ».
Derrière ces chiffres se cachent des facteurs de risque ici bien identifiés : l’âge des bovins (plus ils vieillissent, plus leur probabilité d’avoir été piqués par une tique infectée augmente), la présence d’habitats ouverts naturels (garrigues, prairies, pâturages secs) favorables aux tiques, et chez les animaux sauvages, le sexe mâle, probablement lié à des comportements plus exploratoires. Des facteurs qui amplifient silencieusement la circulation virale et préparent le terrain pour la suite de la chaîne causale.
Conditions favorisant les cas humains
Pour qu’un virus enzootique franchisse la barrière vers l’humain, il faut que les conditions convergent. C’est précisément ce qui s’est produit en Espagne : quelques années après la détection des tiques infectées chez les cervidés, 17 cas humains autochtones ont été recensés entre 2016 et 2024, dont plusieurs mortels. Au Portugal, un premier décès a été enregistré en 2024.
En France, aucun cas humain autochtone n’a encore été confirmé. Mais les zones de forte séroprévalence animale, la présence stable des vecteurs Hyalomma marginatum et l’intensification des échanges agricoles et touristiques créent une configuration similaire à celle observée en Espagne au début de l’expansion des cas.
Les activités humaines en zone rurale (élevage extensif, chasse, randonnée, tourisme vert) augmentent les probabilités de contact avec les tiques infectées ou les fluides animaux contaminés. Ces expositions sont saisonnières et coïncident avec la période d’activité maximale des tiques. Une récente étude de séroprévalence humaine en Corse a ainsi montré une séropositivité totale de 0,08 % dans la population générale et de 0,50 % dans les professions à haut risque (p < 0,01) comme les employés d’abattoirs, vétérinaires, agriculteurs et gardes forestiers – les agriculteurs rapportant des taux élevés de piqûres de tiques, de même que les personnes ayant plus de 10 ans d’exposition professionnelle.
Une dynamique causale documentée
Le modèle proposé par l’équipe de Célia Bernard et repris par plusieurs équipes européennes repose sur une relation causale en trois niveaux :
- Environnement ➝ expansion des vecteurs (climat favorable + oiseaux migrateurs)
- Hôtes animaux ➝ amplification silencieuse (séroprévalence accrue, circulation virale)
- Comportements humains ➝ exposition directe ➝ risque de cas autochtones.
Ces facteurs sont interdépendants : aucun ne suffit seul à provoquer une émergence humaine. Mais leur convergence déclenche la bascule.
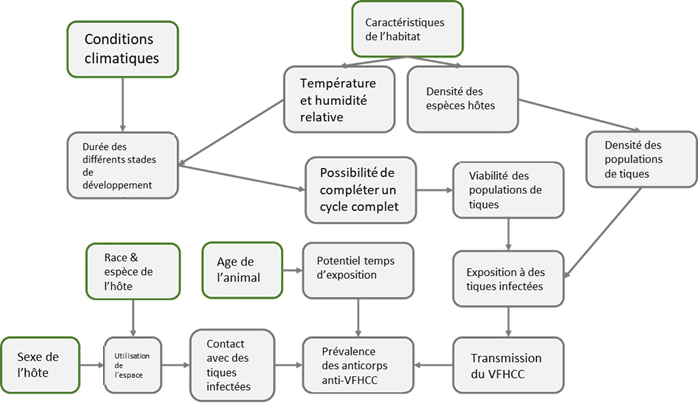
Représentation des relations causales hypothétiques entre les variables explicatives (individuelles, anthropiques et environnementales) et la séropositivité au VFHCC chez les animaux. In Bernard C et al. (2025) https://doi.org/10.1371/journal.pone.0331875
La France dans une phase de pré-émergence
Selon les autorités sanitaires et vétérinaires, la France se trouve aujourd’hui en phase de pré-émergence. Les éléments du cycle sont en place :
- Une circulation virale animale confirmée,
- Une population vectorielle installée,
- Un contexte climatique favorable,
- Une exposition humaine croissante.
Certes le génotype « Africa 3 » du virus détecté en France est moins virulent que certaines lignées observées ailleurs, ce qui pourrait expliquer l’absence de cas cliniques humains à ce jour. Cependant, cette situation ne permet pas d’assurer une évolution future favorable ou défavorable. L’expérience espagnole a montré qu’il suffit d’un été propice et d’une densité vectorielle critique pour que les premiers cas surviennent.
Une vigilance à renforcer
L’émergence éventuelle de la FHCC en France n’est toutefois pas une fatalité. Elle peut être prévenue ou contenue par des actions coordonnées relevant de l’approche One Health :
- Surveillance accrue des tiques vectrices, notamment dans les zones méditerranéennes et pyrénéennes ;
- Surveillance sérologique continue des animaux domestiques et sauvages ;
- Formation des éleveurs et professions à haut risque (cf récente étude se séroprévalence humaine en Corse) et professionnels de santé à la détection précoce et aux gestes de protection ;
- Préparation hospitalière aux protocoles de prise en charge en cas d’infection humaine.
Cette stratégie intégrée est indispensable car la FHCC, avec un taux de létalité compris entre 10 et 50 %, pourrait connaître une diffusion rapide si ces conditions causales se maintiennent ou s’intensifient. La FHCC n’est pas une menace lointaine : c’est une réalité écologique qui s’installe lentement. Le défi français n’est pas de réagir à une épidémie future, mais de l’anticiper en comprenant les relations causales qui la rendent possible.
Pathogénie proposée de la FHCC
A partir de la morsure d’une tique infectée et avec l’aide de la salive de cette dernière, le virus infecterait les cellules dendritiques et macrophages présents dans la peau. Par l’intermédiaire de ces cellules ou directement, le virus se propagerait ensuite par voie hématogène (virémie) via les cellules du système réticuloendothélial ; là, il gagnerait le foie, la rate et les nœuds lymphatiques où il provoquerait la libération massive de cytokines pro-inflammatoires comme l’Interleukine 8 (IL-8), et le facteur de nécrose tissulaire (TNF) alpha. Ceci amplifierait les dégâts endothéliaux, troubles de la coagulation et fuites vasculaires à l’origine d’une perméabilité vasculaire accrue et de manifestations hémorragiques (comme des pétéchies, ecchymoses, saignements internes), de coagulation intravasculaire disséminée, de défaillance multiviscérale et de choc septique.
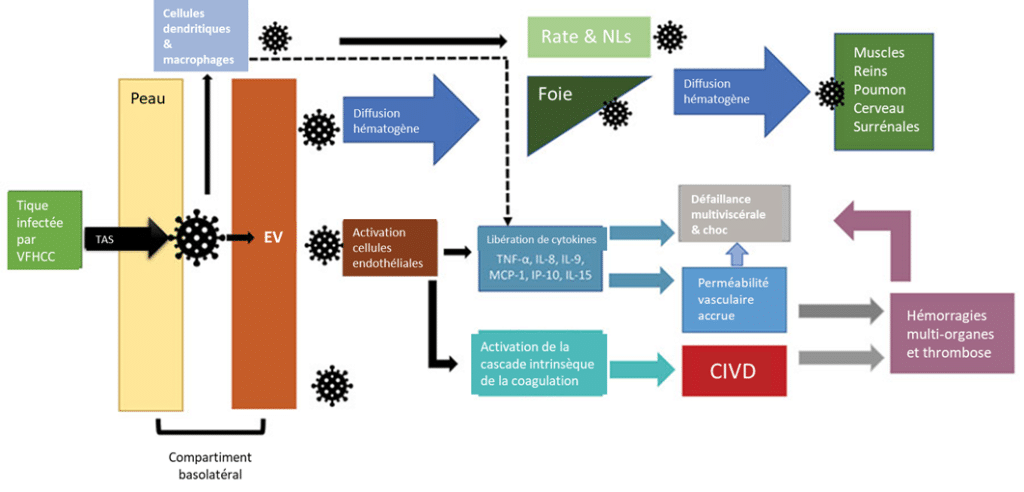
Pathogénie proposée de la FHCC – traduit d’après Frank MG et al. (2024) https://doi.org/10.3201/eid3005.231646 (CIVD = coagulation intravasculaire disséminée ; EV = endothélium vasculaire ; NLs = nœuds lymphatiques ; TAS = transmission aidée par la salive)
Références
- Bernard C, et al. (2025) First detection of Crimean Congo Hemorrhagic Fever antibodies in cattle and wildlife of southern continental France: Investigation of explanatory factors. PLOS ONE 20(9): e0331875. https://doi.org/10.1371/journal.pone.0331875
- Fillâtre P. , M. Revest, P. Tattevin, (2019) Crimean-Congo hemorrhagic fever: An update, Médecine et Maladies Infectieuses, Volume 49, Issue 8, Pages 574-585, https://doi.org/10.1016/j.medmal.2019.09.005 https://www.sciencedirect.com/science/article/pii/S0399077X18308539
- Francesca F. Norman, Octavio A. Arce, Marta Díaz-Menéndez, Moncef Belhassen-García, Marta González-Sanz, Changes in the epidemiology of Crimean-Congo hemorrhagic fever: Impact of travel and a One Health approach in the European region, Travel Medicine and Infectious Disease, Volume 64, 2025, 102806, ISSN 1477-8939, https://doi.org/10.1016/j.tmaid.2025.102806 (https://www.sciencedirect.com/science/article/pii/S1477893925000122 )
- Frank MG, Weaver G, Raabe V. (2024) Crimean Congo Hemorrhagic Fever Virus for Clinicians—Virology, Pathogenesis, and Pathology. Emerging Infectious Diseases. 2024;30(5):847-853. https://doi.org/10.3201/eid3005.231646
- Kiwan P, et al. (2025), Serological evaluation of Crimean-Congo Hemorrhagic fever in humans with High-Risk professional exposure and in residual sera collected in 2022-2023 across Corsica (France), One Health, 20, 2025, 101020, https://doi.org/10.1016/j.onehlt.2025.101020
- Reynard O. et al., La fièvre hémorragique de Crimée-Congo, une future problématique de santé en France ? Med Sci (Paris) 37 (2) 135-140 (2021) https://doi.org/10.1051/medsci/2020277
- Zé-Zé L, Nunes C, Sousa M, de Sousa R, Gomes C, Santos AS, et al. Fatal Case of Crimean-Congo Hemorrhagic Fever, Portugal, 2024. Emerg Infect Dis. 2025;31(1):139-143. https://doi.org/10.3201/eid3101.241264
