On recense environ 3 500 espèces de moustiques dans le monde, mais seules quelques-unes transmettent réellement des virus pathogènes à l’être humain. Parmi elles, Aedes aegypti, surnommé le « moustique de la fièvre jaune », est aujourd’hui reconnu comme l’un des vecteurs les plus efficaces de maladies virales telles que la dengue, Zika, le chikungunya ou encore la fièvre jaune. Pourtant, ce rôle central n’a pas toujours été le sien. Face à l’augmentation continue de ces arbovirosesArbovirose Les arboviroses sont des maladies virales dues à des arbovirus transmis obligatoirement par un vecteur arthropode (moustique, moucheron piqueur, tique) à des hôtes vertébrés (mammifères, oiseaux), d’où leur nom adapté de l’anglais : ARthropod-BOrne virus. des chercheurs se sont intéressés à son histoire au cours de 4 derniers siècles. Ils ont pour cela séquencé 1206 génomes de ce moustique et retracé l’origine de sa forme invasive jusqu’à la traite transatlantique des esclaves, identifiant des signatures génétiques liées à son adaptation à l’être humain. Ces découvertes apportent un éclairage important pour les stratégies de lutte antivectorielle, la surveillance génétique et le développement de nouveaux outils de santé publique.
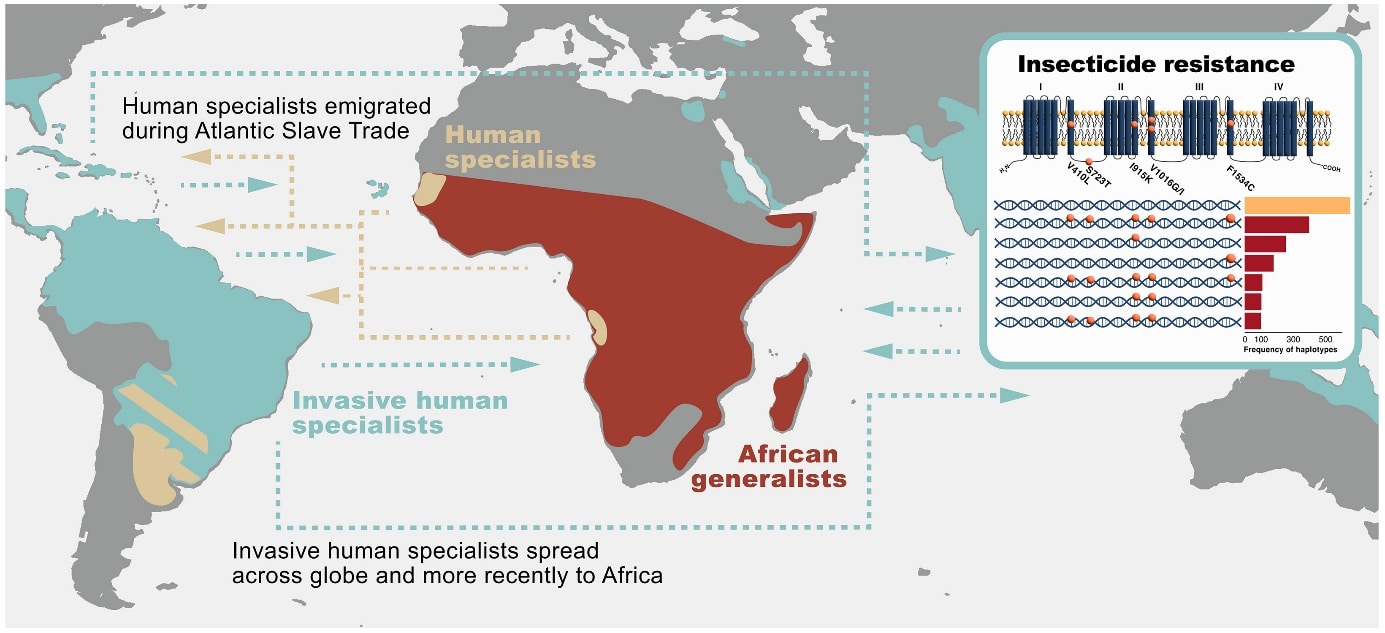
Les migrations mondiales d’Aedes aegypti, espèceinvasive qui propage la résistance aux insecticides et augmente le risque d’arboviroses. L’analyse des séquences d’ADN a révélé que l’origine de la forme invasive d’Ae. aegypti aegypti s’est produite après son déplacement vers les Amériques et les Caraïbes, où la sous-espèce s’est adaptée à de nouveaux environnements. Des mutations conférant des résistances aux insecticides couramment utilisés sont apparues indépendamment en plusieurs endroits, puis se sont propagées à travers des migrations transcontinentales récentes, augmentant ainsi le risque d’arboviroses en Afrique, et ailleurs. In Crawford Jacob E. et al., (2025) https://doi.org/10.1126/science.ads3732
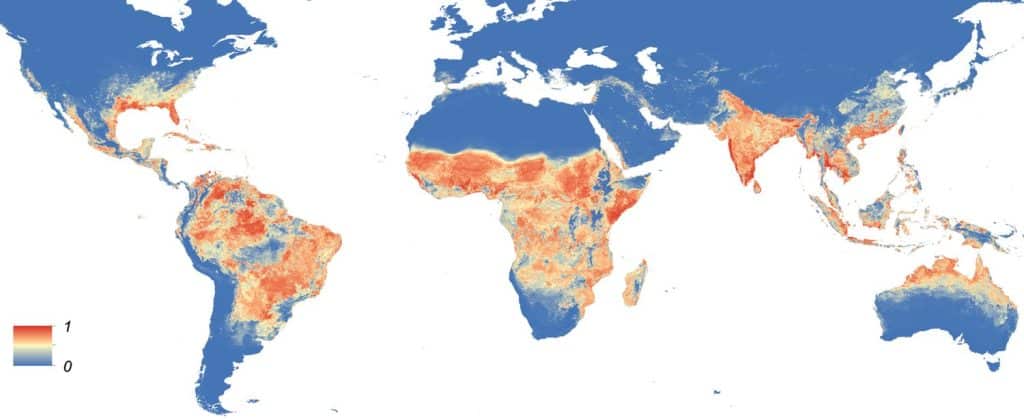
Carte de la répartition mondiale prévue d’Aedes Aegypti (2015) in Kraemer Moritz UG et al., (2015) https://doi.org/10.7554/eLife.08347
Un moustique, deux visages
Aedes aegypti aurait émergé dans la partie sud-ouest de l’océan Indien il y a environ 85 000 ans, pour ensuite coloniser l’Afrique continentale. On en distingue aujourd’hui deux sous-espèces :
- Ae. aegypti formosus (Aaf), restée proche de son habitat forestier, se reproduit dans des contenants naturels comme les trous d’arbres, et pique des hôtes variés, humains compris mais pas exclusivement.
- Ae. aegypti aegypti (Aaa), la forme dite « domestique », s’est spécialisée dans les environnements urbains, utilisant les récipients artificiels pour sa reproduction et se nourrissant presque exclusivement de sang humain.
La transition entre ces deux formes, qui semble récente à l’échelle de l’évolution, s’explique par les pressions environnementales rencontrées lors de l’expansion de l’espèce. Pour survivre dans des zones plus arides, certaines populations ont dû s’adapter à la proximité de l’homme et à ses ressources. Cette transition a façonné la sous-espèce invasive qui, aujourd’hui, menace près de quatre milliards de personnes à travers le monde.

Vue dorsale du tergite abdominal 1 d’Aedes aegypti aegypti (Aaa) et d’Ae. aegypti formosus (Aaf) in Kawada H. et al. (2016) https://doi.org/10.1371/journal.pntd.0004780
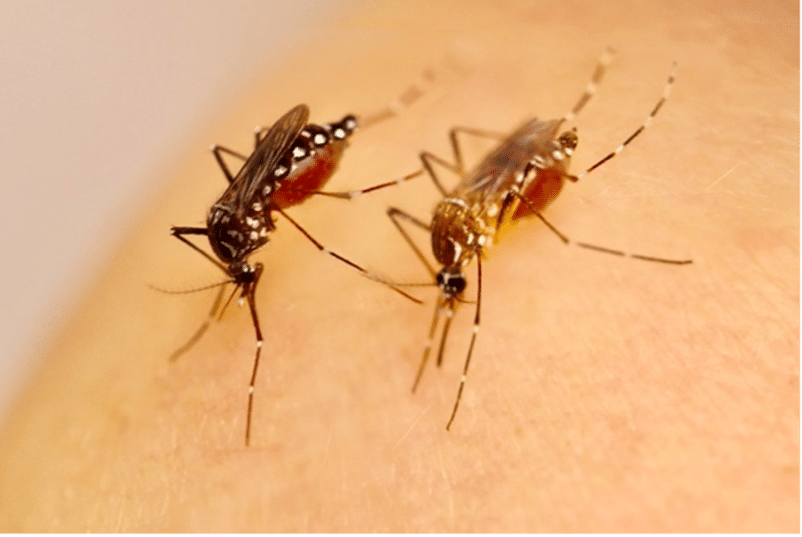
Femelles de la sous-espèce native Aedes aegypti formosus (à gauche) et de la sous-espèce invasive mondiale Aedes aegypti aegypti (à droite). Credits: Greg Murray/Blaise Daures/Louis Lambrechts in https://doi.org/10.25250/thescbr.brk604
La traite transatlantique des esclaves, point de bascule
Les analyses génomiques indiquent que l’histoire moderne d’Aedes aegypti est intimement liée à celle de l’humanité. L’étude de Crawford et al. montre que le passage de la forme forestière africaine à la forme domestique invasive est survenu il y a environ 300 à 400 ans, au moment où les routes de la traite transatlantique des esclaves reliaient l’Afrique, les Amériques et les Caraïbes.
Des analyses génétiques montrent que toutes les populations invasives d’Aaa sont issues d’une lignée monophylétique, c’est-à-dire d’un seul événement évolutif majeur ayant transformé une population ancestrale (proto-Aaa) en la forme invasive que l’on connaît aujourd’hui. Toutefois, le lieu exact et le moment de cette transformation restent débattus. La difficulté réside en partie dans l’histoire d’éradication d’Ae. aegypti dans les Amériques et en Europe durant les années 1950-60, qui a masqué les signaux génétiques des populations d’origine.
Les « proto-Aaa », populations intermédiaires déjà partiellement adaptées à l’homme, auraient été transportés dans les cales de navires où l’eau stagnante offrait des gîtes larvaires. Arrivés dans les ports américains et caribéens, ces moustiques ont trouvé des conditions idéales pour se spécialiser : milieux urbains, hôtes humains abondants, climat favorable. C’est dans ce contexte que la lignée invasive Aaa s’est imposée, avec un appauvrissement génétique marqué mais une adaptation rapide aux nouvelles contraintes écologiques.
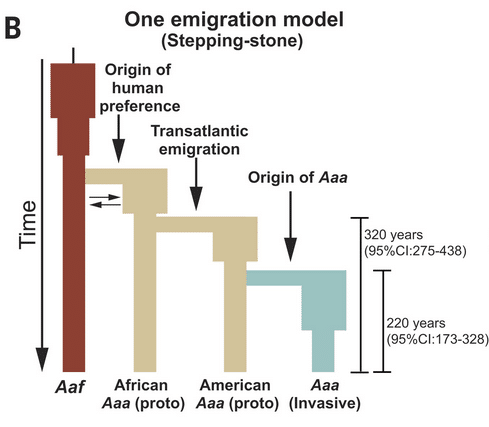
Histoire des populations d’Aaf & Aaa – Modèle avec 1 seule dissémination. In Crawford Jacob E. et al., (2025) https://doi.org/10.1126/science.ads3732
Une expansion mondiale et des ré-invasions
À partir des Amériques, la forme invasive d’Aedes aegypti aurait gagné au XIXᵉ siècle d’autres régions du globe. Les analyses génétiques suggèrent une diffusion vers l’Asie, le Moyen-Orient et le Pacifique via les routes commerciales, en particulier à partir des populations caribéennes. Des ports stratégiques, comme ceux de la Méditerranée ou le canal de Suez, ont joué un rôle d’accélérateurs.
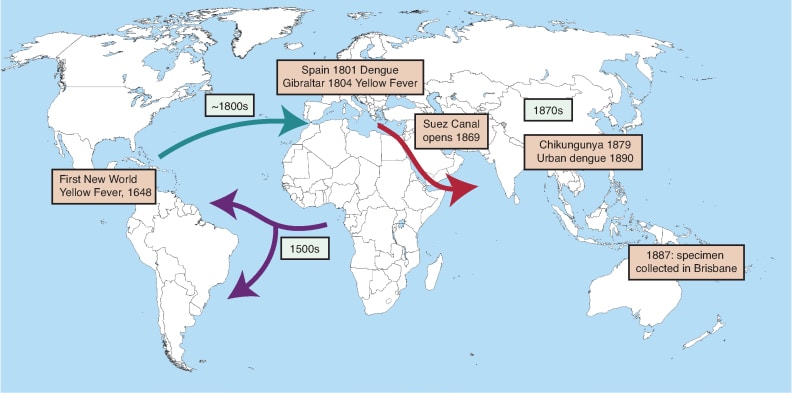
Visualisation des migrations modernes d’Aedes aegypti. Les itinéraires sont visibles avec les dates approximatives proposées et événements épidémiologiques majeurs (encadrés). Les dates correspondent aux dates de séparation des populations de moustiques estimées à partir de données génétiques. In Powell JR, et al. (2018) https://doi.org/10.1093/biosci/biy119
Parallèlement à cette expansion, Aaa a subi des adaptations évolutives majeures. Deux régions génomiques seraient ainsi fortement différenciées dans les populations nord-américaines comparées aux populations proto-Aaa : l’une codant un récepteur de type Toll impliqué dans l’immunité antimicrobienne et antivirale, et l’autre un récepteur au neuropeptide RYamide impliqué dans les fonctions alimentaire, digestive et reproductrice. Ces modifications suggèrent une sélection naturelle favorisant des traits clés pour la survie dans des environnements urbains denses et exposés à de nouveaux pathogènes.
Au milieu du XXᵉ siècle, plusieurs campagnes d’éradication menées en Amérique latine et en Europe ont temporairement réduit sa présence. Mais à partir des années 1970, la mondialisation des échanges a favorisé de nouvelles vagues d’invasion, notamment au Brésil. L’analyse génomique permettrait de déterminer qu’un mélange entre Aaa et proto-Aaa se serait produit il y a environ 20 ans, ce qui coïncide avec l’intensification des échanges commerciaux dans le cadre du Mercosur. Aujourd’hui, l’espèce est de retour dans de nombreuses régions, souvent sous des formes issues de mélanges génétiques entre populations africaines et américaines. Des analyses de mélange révèlent des contacts génétiques récents entre Aaa et Aaf, notamment dans des zones côtières (Sénégal, Angola, Kenya), ce qui correspond géographiquement aux zones rapportant des épidémies de dengue. Ces brassages expliquent en partie l’émergence accrue d’épidémies de dengue dans des zones jusque-là relativement épargnées, notamment en Afrique de l’Ouest et de l’Est.
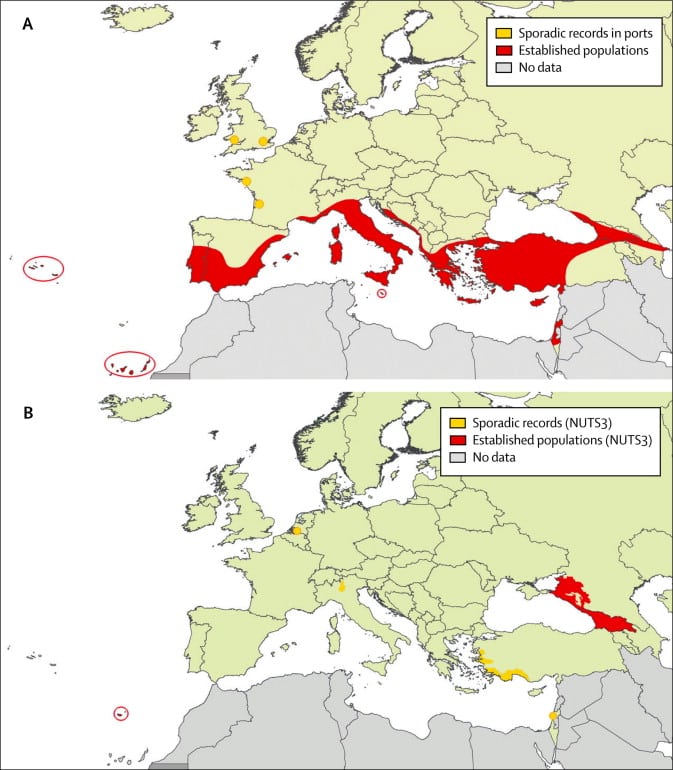
Distribution d’Aedes aegypti au sein de la région Europe de l’OMS. Distribution historique jusqu’en 1960 (A) et actuelle (B). In Schaffner, Francis et al. (2014) https://doi.org/10.1016/S1473-3099(14)70834-5
Résistance aux insecticides : une menace mondiale
La lutte antivectorielle repose depuis des décennies sur l’usage massif d’insecticides, en particulier les pyréthrinoïdes. Mais cet usage intensif a provoqué une pression sélective favorisant l’apparition de mutations de résistance dites KDR (knockdown resistance). L’étude montre que ces mutations sont apparues indépendamment à plusieurs endroits du globe avant de diffuser via les mouvements de populations de moustiques.
- En Amérique et aux Caraïbes, la mutation F1534C est aujourd’hui dominante.
- En Asie, la mutation V1016G s’est imposée.
- En Afrique, les fréquences de mutations KDR restent globalement plus faibles, mais certaines zones côtières comme Luanda ou Ouagadougou présentent déjà des taux élevés, liés aux mélanges génétiques récents entre Aaf et Aaa.
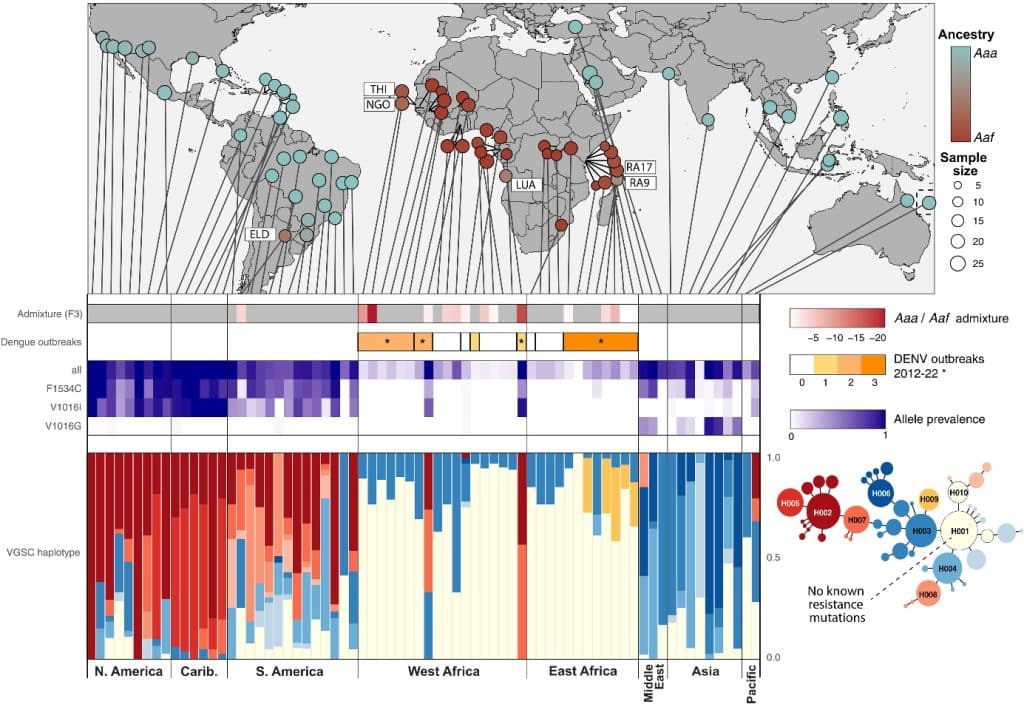
Le mélange Aaa/Aaf dissémine la résistance aux insecticides et le risque de dengue. En haut la carte de répartition des mélanges Aaa/Aaf selon 2 méthodes différentes. Au milieu le nombre d’épidémies de dengue (2012-2022) ainsi que la prévalencePrévalence Nombre de personnes atteintes par une infection ou autre maladie donnée dans une population déterminée. des allèles KDR dans les populations correspondantes, codée selon l’intensité. En bas le réseau des 10 principaux haplotypes KDR et leurs relations, ainsi que leur fréquence par continent. In Crawford Jacob E. et al., (2025) https://doi.org/10.1126/science.ads3732
Ces résistances compromettent l’efficacité des campagnes de lutte et posent un défi majeur aux autorités sanitaires. La variabilité géographique observée fait qu’une stratégie uniforme ne peut suffire : la surveillance locale des résistances devient indispensable.
Un « super-vecteur » façonné par l’homme
En retraçant l’histoire évolutive d’Aedes aegypti, les chercheurs distinguent quatre grandes étapes :
- Dispersion initiale de populations proto-Aaa durant la traite atlantique.
- Adaptation rapide à l’homme et aux environnements urbains en Amérique, donnant naissance à la forme invasive.
- Éradication partielle au milieu du XXᵉ siècle, suivie de reculs temporaires.
- Ré-invasions contemporaines et mélanges génétiques, favorisant la résistance aux insecticides et l’augmentation du risque épidémique.
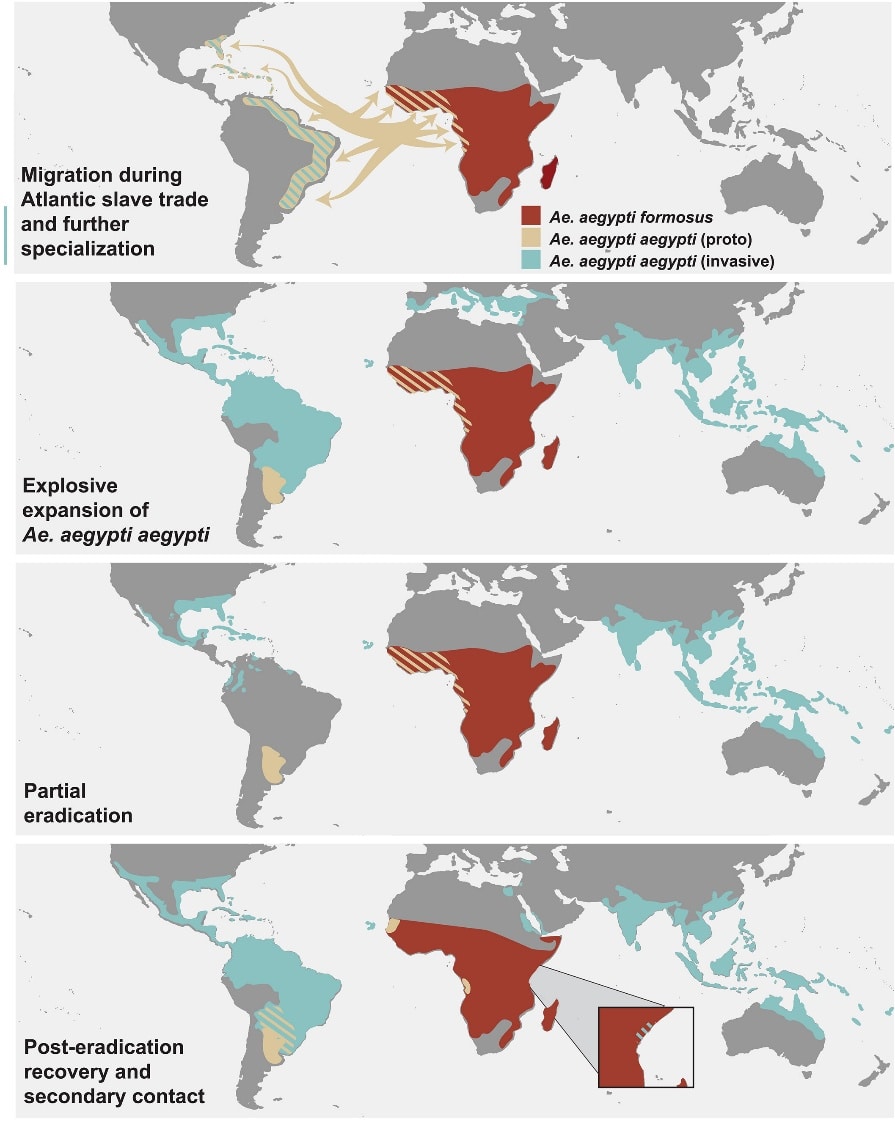
Les 4 grandes phases de l’évolution d’Aedes aegypti aegypti, espèce invasive. Les différents sous-espèces (Ae. aegypti formosus – Aaf ou Ae. aegypti aegypti – Aaa) et sous-groupes (protoAaa ou Aaa invasif) sont représentés par une couleur différente selon la légende. Les répartitions géographiques sont déduites des archives historiques et interprétées à partir des résultats de l’étude, y compris la région d’Argentine où le proto-Aaa aurait échappé à l’éradication. Chaque phase est décrite dans le coin inférieur gauche. Les flèches dans la première phase indiquent les mouvements du proto-Aaa pendant la traite transatlantique des esclaves. Les zones hachurées indiquent la présence de plusieurs formes ou sous-espèces dans une même région à cette époque, ou des régions où des traces génétiques des deux groupes sont retrouvées dans les échantillons actuels, ce qui est cohérent avec une migration récente ou ancienne. In Crawford Jacob E. et al., (2025) https://doi.org/10.1126/science.ads3732
Cette trajectoire illustre combien les dynamiques humaines – esclavage, commerce, urbanisation, mondialisation – ont façonné l’évolution d’un moustique devenu redoutable. Sa capacité d’adaptation génétique et écologique en fait aujourd’hui l’un des principaux ennemis de santé publique mondiale.
Conséquences pour la santé publique
Le réchauffement climatique, l’urbanisation rapide et la mobilité internationale offrent à Aedes aegypti de nouveaux territoires de colonisation, y compris dans des zones tempérées. En Europe, sa présence est désormais signalée dans plusieurs pays méditerranéens, faisant craindre l’installation durable du moustique.
Le projet Aaeg1200, en produisant une cartographie génétique mondiale de l’espèce, constitue une ressource précieuse pour anticiper les mouvements futurs de populations invasives, identifier les souches les plus dangereuses, suivre l’évolution des résistances, et guider les stratégies de lutte ciblées.
L’avenir de la lutte contre la dengue et les autres arboviroses dépendra largement de notre capacité à combiner surveillance génomique, innovations en matière de contrôle des moustiques (comme l’utilisation de WolbachiaWolbachia L’utilisation de la bactérie intracellulaire Wolbachia est l’une des formes de lutte biologique utilisée contre certains virus comme la dengue. Elle est naturellement présente chez certains insectes et empêche les arbovirus de se multiplier dans l’organisme des moustiques. Contrairement à Ae. albopictus, Ae. aegypti, principal vecteur des arboviroses, est naturellement dépourvu de la bactérie Wolbachia. La transfection de wMelPop issus de la mouche drosophile chez Ae. aegypti conduit à une diminution des densités de populations par une stérilité produite lors de l’accouplement d’une femelle et d’un mâle infectés par des souches de Wolbachia différentes, la diminution de la compétence vectorielle pour différents arbovirus et la réduction de la durée de vie du moustique. ou les moustiques génétiquement modifiés) et stratégies locales adaptées.
Conclusion
L’histoire d’Aedes aegypti est celle d’un insecte devenu « super-vecteur » grâce à sa proximité avec l’homme. Né en Afrique, façonné par la traite transatlantique, renforcé par la mondialisation et désormais armé de résistances aux insecticides, il illustre les liens étroits entre évolutions biologiques et dynamiques humaines. Face au risque croissant de dengue, cette connaissance scientifique constitue un outil essentiel pour mieux comprendre et mieux agir.
Références
- Kawada Hitoshi et al., Discovery of Point Mutations in the Voltage-Gated Sodium Channel from African Aedes aegypti Populations: Potential Phylogenetic Reasons for Gene Introgression. (2016) PLoS Negl Trop Dis 10(6): e0004780. https://doi.org/10.1371/journal.pntd.0004780
- Crawford Jacob E. et al., (2025) 1206 genomes reveal origin and movement of Aedes aegypti driving increased dengue risk. Science 389, eads3732(2025). https://doi.org/10.1126/science.ads3732
- Aedes aegypti: Rise of a super-vector (2021) – The Science Breaker Fabien Aubry & Louis Lambrechts https://doi.org/10.25250/thescbr.brk604
- Kraemer Moritz UG et al., (2015) The global distribution of the arbovirusArbovirose Les arboviroses sont des maladies virales dues à des arbovirus transmis obligatoirement par un vecteur arthropode (moustique, moucheron piqueur, tique) à des hôtes vertébrés (mammifères, oiseaux), d’où leur nom adapté de l’anglais : ARthropod-BOrne virus. vectors Aedes aegypti and Ae. albopictus eLife 4:e08347. https://doi.org/10.7554/eLife.08347
- Powell JR, et al. (2018) Recent History of Aedes aegypti: Vector Genomics and Epidemiology Records. Bioscience;68(11):854-860. https://doi.org/10.1093/biosci/biy119 . PMID: 30464351; PMCID: PMC6238964.
- Schaffner, Francis et al. (2014), Dengue and dengue vectors in the WHO European region: past, present, and scenarios for the future. The Lancet Infectious Diseases, 14(12), 1271 – 1280. https://doi.org/10.1016/S1473-3099(14)70834-5
