Le virus Nipah, une menace émergente sous surveillance mondiale
Le virus Nipah (NiV) est aujourd’hui considéré comme l’un des agents pathogènes émergents les plus préoccupants au niveau international en raison de son potentiel pandémique. Classé par l’Organisation mondiale de la santé (OMS) parmi les virus prioritaires pour la recherche et le développement de contre-mesures médicales, il cumule plusieurs caractéristiques redoutables : une origine zoonotique complexe, une létalité humaine élevée, l’absence de traitement antiviral spécifique validé et un potentiel de transmission interhumaine, certes limité mais documenté.
Identifié pour la première fois à la fin des années 1990 en Malaisie et à Singapour, le virus Nipah a depuis provoqué des flambées épidémiques récurrentes, principalement en Asie du Sud et du Sud-Est, notamment au Bangladesh et en Inde. Les récents signalements de clusters nosocomiaux en Inde rappellent que, malgré leur taille généralement réduite, ces épisodes soulèvent des enjeux sanitaires majeurs, tant au niveau local que global.
Comprendre le virus Nipah implique d’analyser ses réservoirs animaux, ses mécanismes de transmission à l’humain, sa pathogénicité, mais aussi les déterminants écologiques, sociaux et sanitaires qui favorisent son émergence.
Origine et réservoirs animaux : une zoonose liée aux chauves-souris frugivores
Le virus Nipah appartient au genre Henipavirus, au sein de la famille des Paramyxoviridae. Son réservoir naturel est constitué principalement de chauves-souris frugivores du genre Pteropus, largement présentes en Asie, en Océanie et dans certaines régions d’Afrique. Chez ces animaux, l’infection est généralement asymptomatique. Le virus est excrété dans la salive, l’urine et les fèces, ce qui facilite la contamination de l’environnement et des denrées alimentaires. Cette particularité explique pourquoi les transmissions zoonotiques sont souvent indirectes, via des aliments ou des surfaces souillées.
Dans certains contextes, des hôtes intermédiaires ont joué un rôle clé. Lors de la première grande épidémie en Malaisie (1998-1999), les porcs domestiques ont servi d’amplificateurs viraux, transmettant l’infection aux éleveurs et aux travailleurs agricoles. D’autres espèces animales, comme les chevaux, les chèvres ou les chats, peuvent être infectées, bien que leur rôle épidémiologique reste secondaire.
Modalités de transmission à l’être humain : des voies multiples mais ciblées
Transmission zoonotique directe et alimentaire
La transmission du virus Nipah à l’humain survient le plus souvent lors de contacts étroits avec des animaux infectés ou par la consommation d’aliments contaminés. L’exemple le plus documenté concerne la sève de palmier-dattier crue, consommée dans certaines régions d’Inde et du Bangladesh. Récoltée dans des récipients ouverts, elle peut être souillée par la salive ou l’urine de chauves-souris.
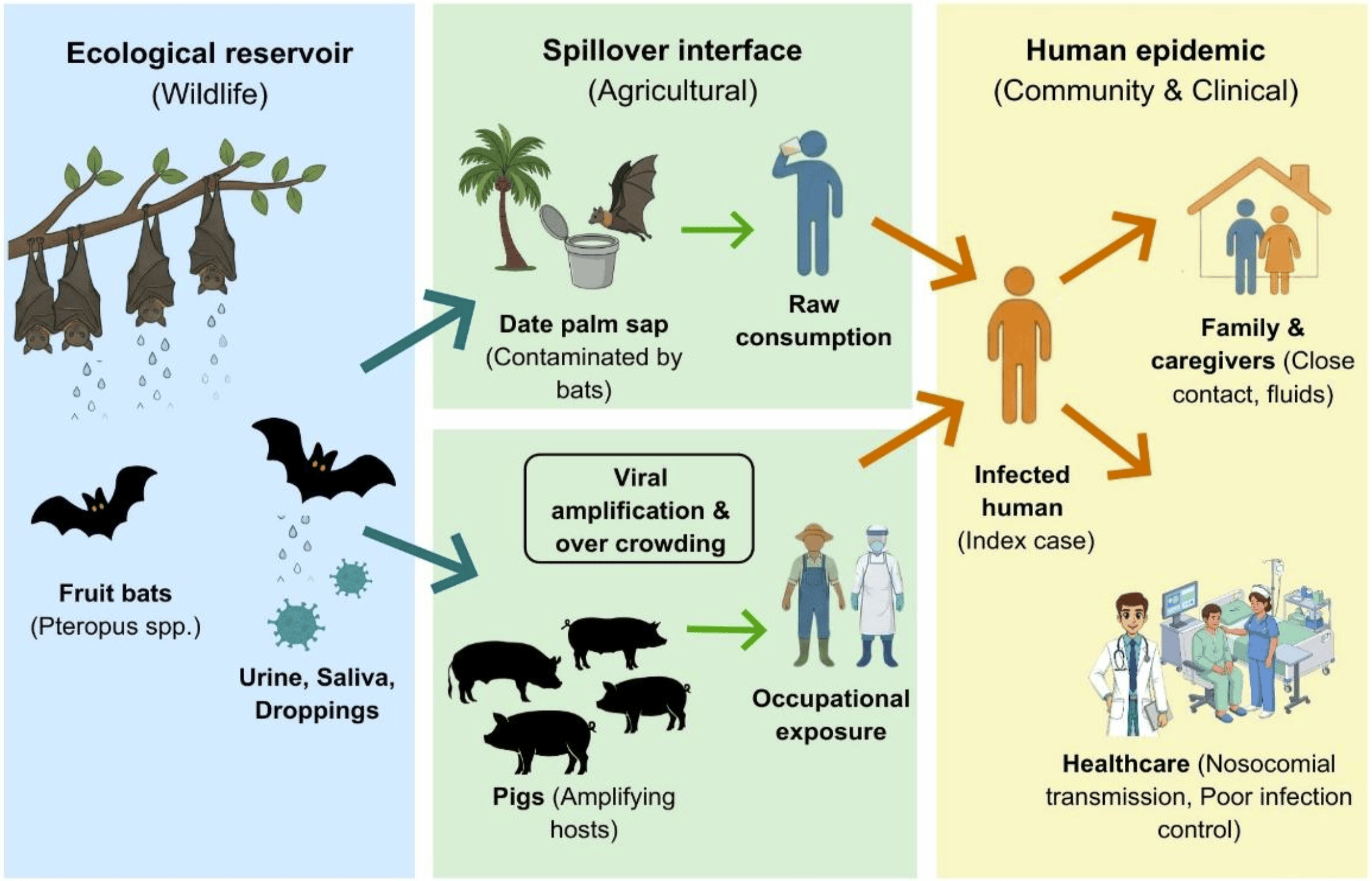
Les fruits partiellement consommés par des chauves-souris représentent une autre source de contamination potentielle, de même que le contact avec des animaux d’élevage infectés.
Transmission interhumaine : un risque réel mais limité
Contrairement à de nombreux virus respiratoires, le virus Nipah ne se transmet pas facilement d’une personne à l’autre. Toutefois, des transmissions interhumaines ont été clairement établies, notamment dans les cercles familiaux et en milieu hospitalier. Les clusters observés en 2018 dans le Kerala, en Inde, illustrent ce risque : plusieurs cas ont concerné des professionnels de santé, exposés lors de soins prodigués à des patients infectés non diagnostiqués. La transmission s’effectue alors par contact étroit avec des sécrétions respiratoires ou des fluides biologiques.
Les données épidémiologiques disponibles indiquent un nombre de reproduction de base (R₀) généralement inférieur à 1, ce qui limite la propagation communautaire soutenue, mais n’exclut pas des flambées localisées.
Manifestations cliniques et évolution de la maladie
L’infection par le virus Nipah présente une grande variabilité clinique. Après une période d’incubation généralement comprise entre 4 et 14 jours – pouvant exceptionnellement s’étendre jusqu’à 45 jours – les patients peuvent rester asymptomatiques ou développer des signes non spécifiques. Les symptômes initiaux incluent de la fièvre, des céphalées, des myalgies, des vomissements et des maux de gorge.
Dans les formes sévères, l’évolution peut être rapide vers une atteinte neurologique grave : encéphalite aiguë, convulsions, troubles de la conscience, coma. Une atteinte respiratoire, sous forme de pneumonie ou de détresse respiratoire aiguë, est également possible.
Le taux de létalité rapporté varie fortement selon les flambées, oscillant entre 40 % et 75 %. Parmi les survivants, environ 1 patient sur 5 présente des séquelles neurologiques persistantes, parfois invalidantes.
Enjeux de santé publique : surveillance, contrôle et réponse aux épidémies
La rareté des cas et la non-spécificité des symptômes initiaux rendent le diagnostic du virus Nipah particulièrement difficile. La confirmation repose sur des techniques de biologie moléculaire (RT-PCR) ou sérologiques, nécessitant des laboratoires de haute sécurité biologique. Les autorités sanitaires des pays concernés ont renforcé les dispositifs de surveillance, notamment en milieu hospitalier, afin de détecter rapidement les cas suspects et de limiter les transmissions secondaires.
En l’absence de traitement spécifique, la prévention repose essentiellement sur des mesures comportementales et sanitaires, rappellent des experts (3) : éviter la consommation de sève de palmier crue, laver et éplucher soigneusement les fruits, éviter les fruits tombés au sol ou présentant des traces de morsure, limiter les contacts avec les chauves-souris et les animaux malades, appliquer strictement les mesures de contrôle des infections dans les établissements de santé.
Les épisodes récents ont également conduit certains pays à renforcer le dépistage des voyageurs en provenance de zones touchées, sans pour autant considérer le risque d’importation comme élevé.
Recherche et perspectives thérapeutiques : des avancées encore insuffisantes
À ce jour, aucun antiviral ni vaccin n’est approuvé pour le traitement ou la prévention de l’infection par le virus Nipah. La prise en charge reste essentiellement symptomatique, accompagnée de soins de support (2).
Toutefois, plusieurs pistes sont en développement. Des candidats vaccins, dont un vaccin à vecteur adénoviral développé par l’Université d’Oxford (ChAdOx1 NipahB), ont atteint les phases précoces d’essais cliniques dans des régions à risque, selon un expert anglais. Parallèlement, des anticorps monoclonaux sont à l’étude comme outils de prophylaxie ou de traitement post-exposition. Ces avancées restent néanmoins freinées par la rareté et l’imprévisibilité des flambées, qui compliquent la conduite d’essais cliniques de grande ampleur.
Conclusion : une menace limitée mais stratégique pour la préparation pandémique
Le virus Nipah ne présente pas, à ce stade, un risque de pandémie comparable à celui de virus hautement transmissibles comme le Sars-CoV-2. Néanmoins, son potentiel zoonotique, sa létalité élevée et son absence de contre-mesures médicales validées en font un modèle emblématique des défis posés par les maladies émergentes.
Dans un contexte de changements environnementaux, de déforestation et d’intensification des interactions entre humains et faune sauvage, la surveillance du virus Nipah dépasse le cadre régional. Il constitue un signal d’alerte sur la nécessité d’investir durablement dans la recherche, la préparation sanitaire et l’approche « One Health », intégrant santé humaine, animale et environnementale.
Références
- Goswami, Chandrani, Sophia Makdoh Gogoi, Dimpi Choudhury, Nayanmoni Konwar, Karabi Phukan, and Manmi Kalita. 2026. “Nipah Virus: Understanding Its Zoonotic Potential and Public Health Implications”. Journal of Advances in Biology & Biotechnology 29 (1):476-89.https://doi.org/10.9734/jabb/2026/v29i13550
- Nipah virus disease: what can we do to improve patient care ? Hassan, Md Zakiul et al. The Lancet Infectious Diseases, Volume 24, Issue 7, e463 – e471https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(23)00707-7/abstract
- Expert reactions to Nipal virus outbreak, 28 janvier 2026,https://www.sciencemediacentre.org/expert-reaction-to-nipah-virus-outbreak/
