Parmi les virus de la grippe aviaire (VGA), les virus influenza de type A avec une forte létalité, ont des génomes de 8 segments et encodent au moins 11 protéines différentes, au sein desquelles les glycoprotéines hémagglutinine (HA) et la neuraminidase (NA) classées chez les espèces aviaires en 16 et 9 sous-types, respectivement. Ces deux protéines séparent et déterminent les sérotypes des VGA sur la base de leurs variations génétiques.
Les VGA sont classés en deux grands groupes selon leur pathogénicité chez les volailles, déterminée par l’indice de pathogénicité intraveineux (IPIV) : les virus de l’influenza aviaire hautement pathogènes (IAHP) à l’origine de signes cliniques et létalité, et les virus influenza aviaire faiblement pathogènes (IAFP) [Test OIE avec un score supérieur à 1,2].
Dans les dernières années, la transmission de souches de IAHP telles que H5N1, H5N8, et H7N9 a représenté des menaces sérieuses pour la santé publique mondiale. Au sein des différentes souches de virus IAHP, le H5N1 est souvent considéré comme le plus pathogène, avec une forte létalité chez les volailles et les humains.
Deux décades après la « grippe aviaire » à H5N1 des volailles en Asie du Sud-Est, ses descendants ont resurgi et sont à l’origine d’une panzootie de grippe aviaire à H5N1 chez les animaux sauvages qui est favorisée par:
- une propagation intercontinentale rapide, atteignant l’Amérique du Sud et l’Antarctique pour la première fois
- une évolution rapide via des réassortiments génomiques
- et des débordements (« spillover ») fréquents vers les mammifères terrestres et marins.
Données épidémiologiques animales (2024-2025)
Le virus a montré une transmission soutenue de mammifère à mammifère dans de multiples cadres, par exemple des fermes à fourrure (visons et renards) en Europe, des colonies de mammifères marins en Amérique du Sud, et des vaches laitières aux États-Unis d’Amérique (près de 1 000 fermes concernées dans 17 États nord-américains entre le 24 mars 2024 et le 18 mars 2025), soulevant des questions quant au risque d’une pandémie pour l’homme. Même si historiquement, les cochons sont considérés comme des hôtes intermédiaires optimaux pour aider à l’adaptation des virus grippaux aux mammifères, avant de passer à l’homme, l’écologie récente altérée du H5N1 semble ouvrir la porte à de nouvelles voies évolutives. Les vaches laitières, les visons d’élevage, ou les lions de mer sud-américains ont le potentiel de servir de plateforme de lancement pour la transmission du virus de la grippe aviaire à l’homme.
Récemment, des infections ont été recensées (plus de 500 pour l’USDA – US Department of Agriculture) chez d’autres espèces animales : des rongeurs comme des souris domestiques (mus musculus), et des rats (noir, Rattus rattus et brun, Rattus norvegicus), et des carnivores domestiques et sauvages. Les chats aussi semblent désormais compter parmi les espèces sensibles (avec des formes neurologiques sévères), via la consommation de lait dans les fermes de vaches laitières américaines, la consommation de nourriture industrielle à base de viande non traitée et aussi potentiellement, de chat à chat, en l’absence d’autre source documentée.
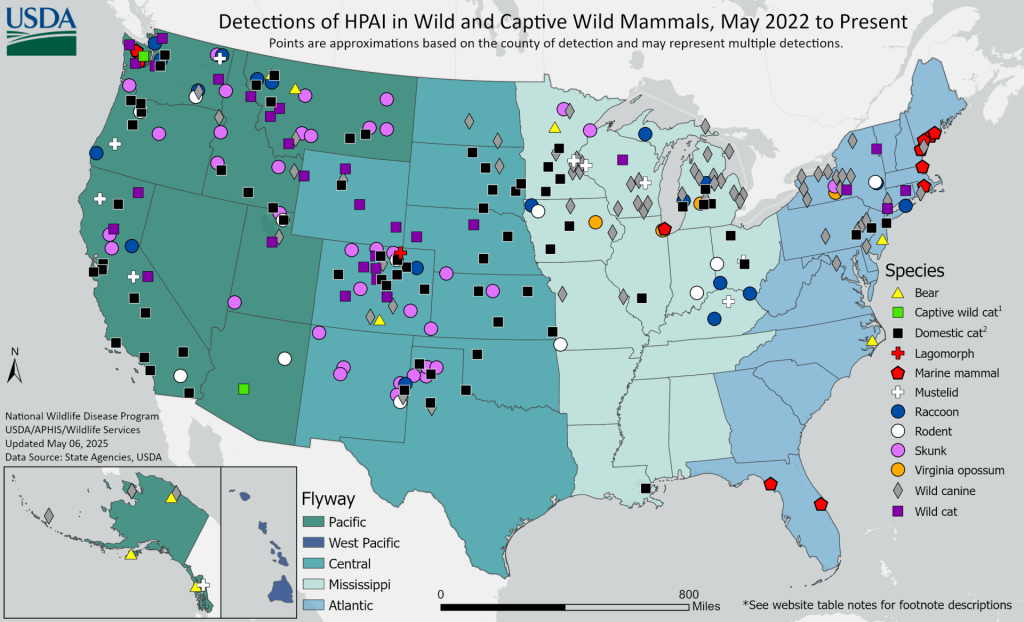
H5NA – une écologie altérée récemment
Les virus ont besoin de détourner les ressources cellulaires pour copier leurs génomes. C’est ainsi qu’au moins quatre mutations (E627K, Q591K/R56, D701N et M631L) de la protéine polymérase basique PB2 de l’influenza aviaire permettent au virus d’utiliser la protéine ANP32, qui aide à la synthèse d’ARN viral par la cellule hôte pour produire de nouvelles particules virales.
La barrière évolutive de cette adaptation du virus influenza aviaire semble faible, car ces mutations de la PB2 ont émergé rapidement et de manière répétée à la suite du débordement (spillover) du H5N1 vers les mammifères : M631L16 chez les bovins, E627K42 dans différentes fermes à visons en Finlande, et Q591K et D701N chez les mammifères marins en Amérique du Sud. La mutation T271A de la PB2 vue chez les visons en Espagne est aussi suspectée d’être impliquée dans une adaptation aux mammifères, mais son phénotype est moins caractérisé.
Des contraintes évolutives sur la glycoprotéine HA pour se lier à son récepteur cellulaire, l’acide sialique
Pour entrer dans les cellules hôtes, les virus influenza se lient généralement via leurs glycoprotéines HA aux glucides de la surface cellulaire qui arborent des récepteurs : les acides sialiques liés au galactose par des liaisons glycosidiques en α2,3 ou α2,6 avec différentes distributions chez les oiseaux, humains et autres espèces de mammifères. Par exemple, la forme α2,3-liée est abondante dans les tissus aviaires, la glande mammaire des vaches et le tractus respiratoire inférieur humain, ainsi que la conjonctive, alors que la forme en α2,6 est abondante dans le tractus respiratoire supérieur humain. Pour que les VGA aient un potentiel pandémique, il faudrait que l’HA puisse après mutation se lier aux acides sialiques liés en α2,6…
Alors que les cas humains documentés de débordements (spillover) du H5N1 à partir de bovins ont principalement concerné la conjonctive, les cas antérieurs de H5N1 chez les humains avaient infecté le tractus respiratoire inférieur, ce qui a probablement contribué à la sévérité de ces infections (létalité proche de 50%). Pour se transmettre efficacement par voie respiratoire, les virus influenza doivent se répliquer dans le tractus respiratoire supérieur.
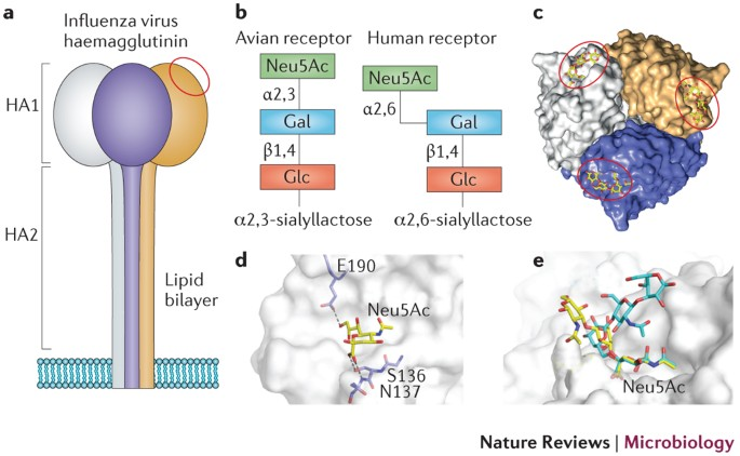
Des contraintes évolutives sur l’HA – la stabilité de l’HA
La troisième propriété des VGA connue pour influencer le potentiel pandémique est la stabilité de l’HA qui, comme presque toutes les glycoprotéines de fusion virales, est synthétisée sous une forme métastable. Son exposition à un pH acide déclenche des modifications de l’HA nécessaires à l’entrée complète du virus dans les cellules par fusion des membranes hôte et virale lors de l’endocytose (transport de molécules, voire de particules (virales, bactériennes, etc.), vers l’intérieur de la cellule).
Cependant, si l’HA est très instable, ces modifications se déclenchent trop tôt, ce qui empêche l’infectiosité du virus. Pour se transmettre efficacement d’humain à humain, l’HA doit être stable et déclenchée uniquement à un pH plus acide, afin de survivre au micro-environnement acide des particules en suspension dans l’air et des sécrétions respiratoires des mammifères. Les mutations affectant la stabilité de l’HA se produisent dans toute la protéine, ce qui rend ce phénotype difficile à prédire sur la seule base de la séquence.
Ainsi, bien que les données actuelles ne suggèrent pas que la stabilité de l’HA du virus panzootique H5N1 ait changé, ce phénotype nécessite une surveillance étroite dans les groupes de cas chez les mammifères susceptibles d’être associés à une propagation aérienne, comme chez les otaries, les visons et les bovins.
Bien que la nécessité de plusieurs mutations simultanées dans la polymérase, l’HA et d’autres gènes rende l’évolution d’un virus pandémique moins probable, le réassortiment génomique offre un raccourci évolutif. Pour conserver sa nouveauté antigénique, le virus réassorti devrait conserver le H5 aviaire tout en acquérant d’autres segments du génome. Par conséquent, une contrainte majeure dans l’évolution des virus pandémiques est que la liaison et la stabilité du récepteur de l’HA doivent évoluer par la seule mutation.
Risque de réassortiment du virus H5N1 avec des virus de mammifères
Les chevaux, les chiens, les porcs, les humains, les volailles et les oiseaux sauvages sont des réservoirs de longue date du virus H5N1. Cependant, les espèces de mammifères infectées par les virus H5N1 2.3.4.4b (comme les visons, les mammifères marins, les bovins, les renards, les ratons laveurs et les chats domestiques) ne le sont pas. Les virus de la grippe D sont enzootiques chez les bovins, mais ce virus est trop distinct du virus H5N1 pour qu’un réassortiment puisse se produire.
Il existe des preuves sérologiques d’infections sporadiques par le virus H5N1 chez les bovins depuis des années, mais celles-ci semblaient rares et jamais persistantes. Les dindes et les visons d’élevage possèdent des acides sialiques liés en α2,6 qui les rendent sensibles aux virus humains et porcins, mais les virus d’origine humaine et porcine ne se maintiennent pas à long terme chez les dindes ou les visons. Les mammifères marins sont des hôtes fréquents des VGA, mais ces VGA faiblement pathogènes ne sont généralement pas maintenus à long terme. Les mammifères sauvages ont tendance à être des hôtes accidentels, tandis que l’élevage intensif est plus susceptible de favoriser l’amplification, le maintien sous forme enzootique et l’évolution virale.
Ainsi, la gamme actuelle d’hôtes du virus H5N1 limite les possibilités de réassortiment avec d’autres virus adaptés aux mammifères. Cependant, cela pourrait changer. À l’approche de l’automne dans l’hémisphère Nord, la saison grippale approche. Un ouvrier agricole coinfecté par le virus H5N1 et un virus saisonnier humain offre aux virus aviaires et humains la possibilité de se réassortir et de combiner de nombreuses caractéristiques nécessaires à une propagation efficace chez l’homme, comme cela s’est produit avant les pandémies de H2N2 de 1957 et de H3N2 de 1968. La propagation du virus H5N1 aux porcs, qui semblent être des hôtes appropriés du virus H5N1, selon les études expérimentales, offrirait des possibilités supplémentaires de réassortiment, comme l’illustre le virus pandémique H1N1 d’origine porcine à triple réassortiment de 2009.
La propagation de la grippe des bovins aux porcs est une possibilité connue, car elle se produit déjà dans ce sens pour les virus de la grippe D, aux États-Unis comme dans d’autres pays. L’absence continue du virus H5N1 chez les porcs américains est une grande chance.
Infections humaines (2024-2025) par le virus H5N1
Les agences de santé publique américaines ont testé plus de 860 personnes exposées à des animaux infectés par le virus H5N1 entre le 24 mars 2024 et le 21 mars 2025 et ont identifié 70 cas confirmés – dont 1 mort, et 7 cas probables (non confirmés par les CDC). Ils seraient 93 selon le site de référence Flutracker.
Une petite enquête sérologique sur les anticorps anti-H5N1 chez les travailleurs des élevages laitiers et avicoles du Michigan n’a révélé aucune infection asymptomatique parmi les 35 personnes testées. Cependant, on ignore combien de travailleurs exposés au sein des troupeaux laitiers infectés par le virus H5N1 n’ont pas été testés. Des vétérinaires visitant des fermes laitières infectées par le virus H5N1 ont signalé des cas humains suspects n’ayant jamais été testés, y compris des travailleurs ayant été en contact direct avec le bétail ou non, ce qui soulève des questions quant à une éventuelle transmission interhumaine limitée.
Une transmission interhumaine limitée des souches H5N1 antérieures a été observée en Asie, mais les taux de reproduction sont toujours restés inférieurs à 1. Même de courtes chaînes de transmission interhumaine augmentent le risque d’adaptation du virus à l’homme, en particulier lorsque des mutations multiples ou une co-infection par des virus saisonniers sont nécessaires. La détection de chaînes de transmission rares nécessite une recherche intensive des contacts parmi les travailleurs, les membres de la famille et les autres contacts. Par exemple, une enquête des CDC sur une épidémie zoonotique de VGA survenue en 2012 chez des enfants américains participant à des concours de porcs lors de foires agricoles a révélé une suspicion de transmission interhumaine dans une garderie.
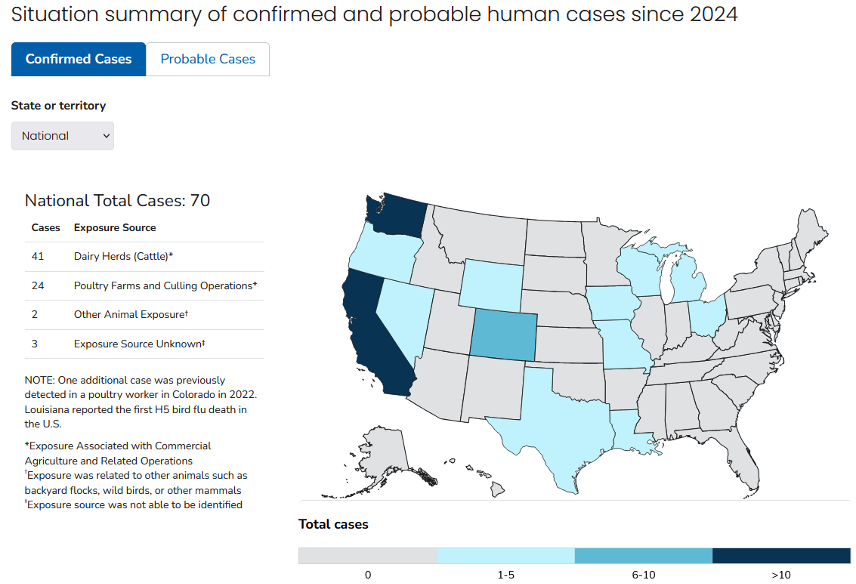
Les foires agricoles ont continué à se tenir pendant l’été 2024 aux États-Unis, introduisant des vaches laitières dans le même environnement où la propagation zoonotique de VGA se produit régulièrement à partir des porcs. Certaines foires exigent que les vaches laitières en lactation soient testées pour le virus H5N1 avant leur arrivée et/ou annulent les démonstrations de traite. Il reste à déterminer dans quelle mesure les tests H5N1 sont effectués sur les humains ou dans les eaux usées lors des foires.
Perspectives d’avenir
Des stocks de vaccins H5 antigéniquement apparentés aux virus 2.3.4.4b circulants sont disponibles et pourraient être produits à grande échelle grâce à des plateformes d’ARNm si le virus H5N1 commençait à se propager chez l’homme. La gravité potentielle d’une future pandémie de H5N1 reste incertaine. Les récentes infections humaines par les virus H5N1 2.3.4.4b ont présenté un taux de mortalité nettement inférieur à celui des précédentes épidémies de H5N1 en Asie, où environ la moitié des personnes infectées déclarées sont décédées. Les symptômes plus légers observés chez les agriculteurs américains ont été attribués à la voie d’infection oculaire et à l’absence de pneumonie virale pulmonaire.
On ignore si les virus B3.13 provoquent une maladie moins grave chez l’homme ou si les cas bénins sont simplement sous-détectés en Asie en raison d’un biais de détermination des cas. Les personnes âgées semblent bénéficier d’une immunité partielle contre le virus H5N1 en raison de leur exposition pendant l’enfance (empreinte immunitaire) aux virus saisonniers H1N1 et H2N2, tandis que les personnes nées depuis la pandémie de H3N2 de 1968 pourraient être plus sensibles à une forme grave de la maladie lors d’une pandémie de H5N1. Un certain degré de réactivité croisée entre le virus H5N1 et la neuraminidase N1 d’origine aviaire, présente chez l’homme depuis la pandémie de 2009, pourrait également offrir une protection partielle. Parallèlement, les symptômes et la gravité de la maladie pourraient évoluer si les virus B3.13 s’adaptent davantage pour infecter les voies respiratoires.
Désormais nous en savons davantage sur la répartition mondiale, la gamme d’hôtes non humains et la diversité génétique du virus H5N1 que sur la quasi-totalité des autres agents pathogènes zoonotiques. Néanmoins, la plupart des tests de dépistage du virus H5N1 sont effectués sur des animaux morts ou gravement malades. L’un des enseignements de la pandémie de covid-19Covid-19 Une maladie à coronavirus, parfois désignée covid (d'après l'acronyme anglais de coronavirus disease) est une maladie causée par un coronavirus (CoV). L'expression peut faire référence aux maladies suivantes : le syndrome respiratoire aigu sévère (SRAS) causé par le virus SARS-CoV, le syndrome respiratoire du Moyen-Orient (MERS) causé par le virus MERS-CoV, la maladie à coronavirus 2019 (Covid-19) causée par le virus SARS-CoV-2. est que les cas symptomatiques entraînant une forme grave de la maladie sont cliniquement importants, mais que les infections subcliniques non observées peuvent jouer un rôle important dans la transmission et alimenter des épidémies à l’échelle d’une population.
La panzootie H5N1 a été définie par des images saisissantes de plages jonchées de carcasses d’otaries ou d’étables de vaches laitières malades dépérissant après avoir cessé de s’alimenter. Mais ce qui inquiète les scientifiques, c’est la possibilité que des chaînes de transmission invisibles se propagent dans les baraquements des ouvriers agricoles, dans les fermes ou les pays en développement, évoluant sous le radar en raison du caractère restrictif des critères de dépistage, de la crainte des autorités gouvernementales ou de la rareté des ressources. Un deuxième enseignement de la pandémie de covid-19 est de ne pas sous-estimer l’importance du comportement humain, de la culture et du contexte économique. Les nouvelles technologies, telles que les vaccins à ARNm, le séquençage de nouvelle génération et les diagnostics CRISPR–Cas, offrent des outils rapides et flexibles pour répondre aux épidémies, mais sont peu utiles lorsqu’elles ne sont pas autorisées dans les élevages et fermes.
Réf :
Charostad J, Rezaei Zadeh Rukerd M, Mahmoudvand S, et al. A comprehensive review of highly pathogenic avian influenza (HPAI) H5N1: An imminent threat at doorstep. Travel Med Infect Dis. 2023;55:102638. doi:10.1016/j.tmaid.2023.102638
Naraharisetti R, Weinberg M, Stoddard B, et al. Highly Pathogenic Avian Influenza A(H5N1) Virus Infection of Indoor Domestic Cats Within Dairy Industry Worker Households — Michigan, May 2024. MMWR Morb Mortal Wkly Rep 2025;74:61–65. DOI: http://dx.doi.org/10.15585/mmwr.mm7405a2
Peacock, T.P., Moncla, L., Dudas, G. et al. The global H5N1 influenza panzootic in mammals. Nature 637, 304–313 (2025). https://doi.org/10.1038/s41586-024-08054-z
Barrière d’espèce
Le concept de barrière d’espèce est lié à l’observation, assez ancienne, que certaines maladies infectieuses sont uniquement observées chez certaines espèces animales ou chez l’homme et presque asymptomatiques chez d’autres, et que dans certaines circonstances en particulier d’épidémies/épizooties, cette barrière d’espèce qui semble protéger certaines espèces peut être franchie. Ce concept a regagné en intérêt au moment de la crise de la vache folle dans les années 1990, avec le fait que les prions, agents transmissibles non conventionnels, à l’origine d’encéphalopathies subaiguës spongiformes transmissibles chez les petits ruminants (tremblante du mouton décrite depuis 1732) et les bovins (ESB ou encéphalopathie spongiforme bovine décrite à partir de 1986) semblaient spécifiques de ces espèces, sauf dans le cas du nouveau variant de la maladie de Creutzfeldt-Jakob, qui a été identifié par la suite, comme une zoonose liée à la consommation de tissus bovins atteints d’ESB.
La barrière d’espèce repose biologiquement sur 3 niveaux :
– Une barrière spatiale et temporelle : la rencontre entre le pathogène et la nouvelle espèce susceptible (hôte) doit se produire dans un laps de temps et selon une voie propice,
– Des barrières physico-chimiques, biologiques et immunitaires : l’agent pathogène doit pénétrer l’organisme hôte en déjouant les mécanismes de défense non spécifiques, comme le mucus, le lysozyme – une protéine globulaire impliquée dans la défense contre les infections bactériennes – les cils vibratiles, les microflores commensales, le pH, la température… et immunitaires comme les défenses innées ou spécifiques (défenses adaptatives ou acquises),
– Des barrières moléculaires (liaison à des récepteurs tissulaires ou cellulaires spécifiques) et métaboliques (le pathogène doit souvent détourner la machinerie cellulaire ou tissulaire à son propre profit pour survivre et se reproduire) : l’agent pathogène doit enfin se reproduire au sein de l’organisme hôte, et ressortir de l’hôte pour se transmettre. Par la suite, du fait de ses mutations, il pourra gagner en efficacité reproductive, jusqu’à un équilibre entre pathogénicité et reproductivité : en bon «parasite» vivant aux dépens de son nouvel hôte, ne pas trop vite tuer ce dernier.
