Le virus, la maladie, les vaccins
Le virus du chikungunya (CHIKV) est transmis par des moustiques, en particulier Aedes albopictus, qui est présent presque partout dans le monde (lire notre fiche sur le chikungunya). Considéré comme l’un des virus les plus susceptibles de se propager à l’échelle de la planète, il est responsable de 5 millions d’infections signalées au cours des 15 dernières années. Bien que la mortalité soit rare, l’infection par ce virus s’accompagne de douleurs articulaires qui peuvent persister pendant des mois, voire des années et toucher jusqu’à 5% des sujets infectés. Enfin, l’infection peut prendre une forme plus sévère comme en a témoigné l’épidémie de 2005 survenue sur l’île de La Réunion associée à la survenue de formes neurologiques graves. Divers types de plateformes ont été utilisées pour développer des vaccins, mais seuls les vaccins vivants atténués et les VLP (Virus Like Particle cf. vaccin HPV) sont en phase 3 d’essais (1).
Questions en suspens concernant la mise au point d’un vaccin contre le CHIKV
Les essais cliniques conventionnels de phase 3 pour les candidats vaccins contre le CHIKV sont difficiles à mener, car les épidémies et leur durée sont imprévisibles. Les anticorps spécifiques au CHIKV jouent un rôle important dans la protection contre l’infection par ce virus et les preuves cumulées suggèrent que les anticorps neutralisants représentent probablement un corrélat de protection. Les autorités de réglementation de la FDA et de l’Agence européenne des médicaments ont approuvé une étude pivot utilisant un substitut de protection comme critère d’immunogénicité, défini ultérieurement comme μPRNT50 150 ou plus, sur la base d’études de transfert passif de sérums humains post-vaccination à des primates non humains après infection avec une souche sauvage (2).
En effet l’Animal Rule de la FDA ou le conditional authorization de l’European Medicine Agency stipulent qu’un marqueur immunologique en corrélation avec la protection dans un modèle animal approprié peut être utilisé pour démontrer l’existence d’un probable bénéfice clinique, qui sert de base pour l’autorisation quand des essais cliniques chez l’homme ne peuvent être techniquement ou éthiquement réalisés. L’industriel s’engage cependant à faire des études supplémentaires après l’autorisation. En 2015, BioThrax (vaccin contre l’Anthrax) est devenu le premier vaccin à être approuvé sur la base de l’animal rule de la FDA (3).
Des résultats
VLA1553 est un vaccin vivant atténué développé par Valneva ® caractérisé par une délétion de 61 acides aminés dans sa protéine non structurale 3, qui atténue le virus in vivo. L’étude VLA1553-301 a été initiée en septembre 2020. Cette étude pivot en double aveugleDouble aveugle L'étude avec répartition aléatoire, randomisé ou en double insu (ou en double aveugle) est une démarche expérimentale utilisée en recherche médicale et pharmaceutique faisant que ni le patient ni le médecin ne sait quel traitement est pris : traitement A ou B, traitement A ou placébo. randomisée et contrôlée par placeboPlacebo Substance inerte, sans activité pharmacologique, ayant la même apparence que le produit auquel on souhaite le comparer. (NDR rien à voir avec le groupe de rock alternatif formé en 1994 à Londres par Brian Molko et Stefan Olsdal.) a été menée sur 44 sites aux États-Unis évaluant 4 115 participants âgés de 18 ans et plus. Une dose lyophilisée de VLA1553 ou du placebo a été administrée par voie intramusculaire en une seule injection.
Son critère principal était de démontrer l’immunogénicitéImmunogénicité Capacité à produire une réponse immunitaire. et l’innocuité du vaccin vingt-huit jours après vaccination avec une seule dose de VLA1553. Les données d’innocuité et d’immunogénicité ont continué d’être évaluées jusqu’au sixième mois. Une surveillance sur une période plus longue encore est prévue.
L’analyse primaire de l’immunogénicité a donc consisté à comparer la proportion observée de participants présentant un taux d’anticorps séroprotecteurs contre le virus du chikungunya 28 jours après la vaccination. 4 128 participants ont été recrutés et assignés de manière aléatoire à recevoir VLA1553 (n=3 093) ou un placebo (n=1 035). La population per-protocole pour l’analyse de l’immunogénicité comprenait 362 participants (266 dans le groupe VLA1553 et 96 dans le groupe placebo). VLA1553 a induit des taux d’anticorps neutralisants séroprotecteurs contre le virus du chikungunya chez 263 (98,9 %) des 266 participants du groupe VLA1553 (IC 95% 96,7-99,8 ; p<0-0001) 28 jours après la vaccination, indépendamment de l’âge, et qui persistent pendant 180 jours.
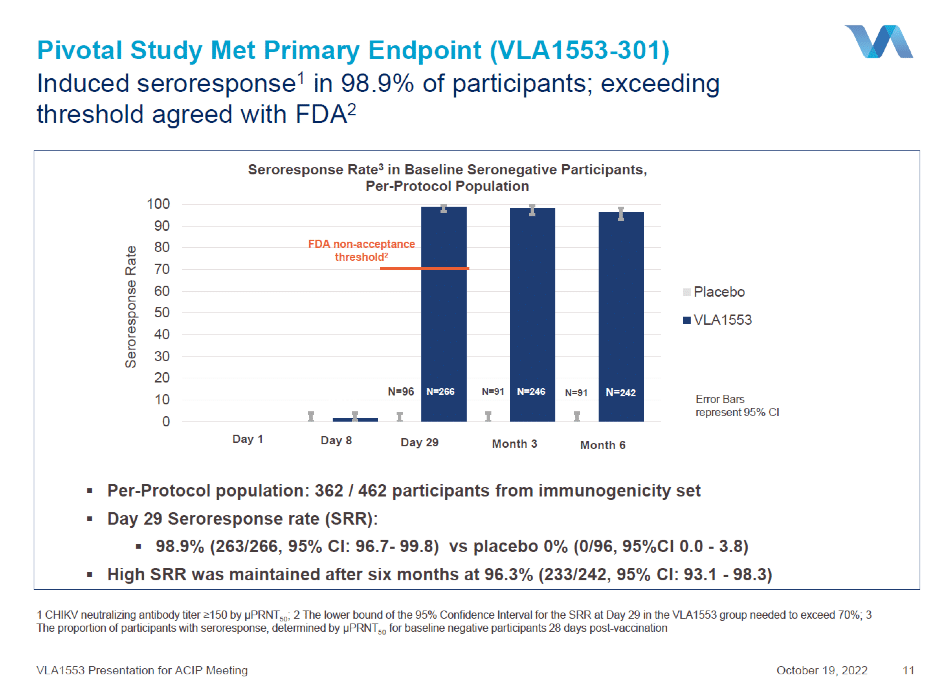
Le taux de séro-protection de 98,9 % a donc largement dépassé le seuil de 70 % convenu avec la FDA, pour servir de marqueur immunologique pouvant être utilisé dans le cadre d’une demande d’autorisation de mise sur le marché pour VLA1553, selon la procédure accélérée octroyée par la FDA. Le candidat vaccin a été fortement immunogène avec une moyenne géométrique des titres d’anticorps (MGT) d’environ 3 270, ce qui confirme le profil d’immunogénicité observé lors de l’essai de phase 1. VLA1553 s’est également révélé hautement immunogène y compris chez les participants âgés, qui ont obtenu des taux de séro-protection et des titres d’anticorps aussi élevés que les adultes plus jeunes, avec un profil de sécurité tout aussi bon.
Le taux observé de fausses couches dans l’essai (23,1%) s’est avéré plus fréquent qu’au cours de la vaccination anti CovidCovid-19 Une maladie à coronavirus, parfois désignée covid (d'après l'acronyme anglais de coronavirus disease) est une maladie causée par un coronavirus (CoV). L'expression peut faire référence aux maladies suivantes : le syndrome respiratoire aigu sévère (SRAS) causé par le virus SARS-CoV, le syndrome respiratoire du Moyen-Orient (MERS) causé par le virus MERS-CoV, la maladie à coronavirus 2019 (Covid-19) causée par le virus SARS-CoV-2. (14 %). Toutefois le faible nombre de fausses couches (3) et l’association de deux d’entre elles avec des causes évidentes de fausse couches (syndrome de Turner chez l’enfant et IMC à 60 de la mère dans l’autre) ne permet pas de conclure. Deux effets indésirables graves ont été imputés au vaccin : une fibromyalgie et un SIADH (syndrome de sécrétion inappropriée d’hormone antidiurétique).
Avantages et limites
La diffusion mondiale d’un pathogène responsable de séquelles fonctionnelles importantes nécessite la mise au point d’un vaccin. Si l’infection par le virus semble conférer une protection très longue contre une réinfection, la durée de la protection post vaccinale reste à démontrer. Les vaccins vivants atténués induisent une protection prolongée possiblement pour la vie entière si aucun évènement à l’origine d’une immunodépression ne survient. Toutefois la durée de cette protection est dépendante de l’âge auquel est effectuée la vaccination, les VVA nécessitant des doses répétées quand la vaccination est effectuée avant l’âge d’un an. Malgré les limites inhérentes à sa nature – vaccin vivant atténué non utilisable dans toutes les populations (sujets immunodéprimés et femmes enceintes) – et les limites actuelles de la possibilité de réaliser des essais d’efficacité, VLA1553 pourrait s’avérer un vaccin très intéressant, compte tenu de sa bonne tolérance, de son efficacité biologique et de son utilisation sous forme d’injection unique.
Les données disponibles à l’heure actuelle en font un bon candidat pour le voyageur sans antécédent d’infection dans le passé et devant voyager en zone d’endémie (4). Des études restent à prévoir dans l’optique d’une vaccination plus large dans les zones d’endémie. Elles comportent des essais chez l’enfant et des études sur la durée de la protection, à garder à l’esprit quand on se souvient que les formes sévères ou à l’origine de séquelles articulaires augmentent en fréquence avec l’âge.
Ref :
1) Christin Schmidt and Barbara S Schnierle, Chikungunya Vaccine Candidates: Current Landscape and Future Prospects Drug Des Devel Ther. 2022; 16: 3663–3673. doi: 10.2147/DDDT.S366112
2) Roques P, Fritzer A, Dereuddre-Bosquet N, et al. Effectiveness of CHIKV vaccine VLA1553 demonstrated by passive transfer of human sera. JCI Insight 2022; 7: e160173.
3) Beasley, D., Brasel, T. & Comer, J. First vaccine approval under the FDA Animal Rule. npj Vaccines 1, 16013 (2016). https://doi.org/10.1038/npjvaccines.2016.13
4) Martina Schneider, Marivic Narciso-Abraham, Sandra Hadl, et al Safety and immunogenicity of a single-shot live-attenuated chikungunya vaccine: a double-blind, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 2023; 401: 2138–47
