La dengue, tout voyageur connait. Mais Zika ? Le cousin de la dengue dans la famille des arbovirosesArbovirose Les arboviroses sont des maladies virales dues à des arbovirus transmis obligatoirement par un vecteur arthropode (moustique, moucheron piqueur, tique) à des hôtes vertébrés (mammifères, oiseaux), d’où leur nom adapté de l’anglais : ARthropod-BOrne virus. qui tire son nom de la forêt où il a été repéré pour la première fois en 1947, transmis par les mêmes moustiques que la dengue, est méconnu en France hexagonale où on l’a vite oublié. On se rappelle à peine des photos chocs des enfants nés microcéphales de mère infectée par le virus Zika au Brésil en 2015- 2016, diffusées dans le monde entier, ou que cette épidémie s’était pourtant invitée dans les Jeux olympiques de Rio en 2016.
Découverte et vagues épidémiques
Le virus Zika appartient à la famille des Flaviviridae du genre Flavivirus comme ceux de la dengue et de la fièvre jaune. C’est un virus enveloppé, à ARN simple brin. Les analyses phylogénétiques montrent qu’il existe deux lignages : un lignage «Afrique» qui se subdivise en deux sous-lignages et un lignage «Asie». Ce virus a été isolé pour la première fois d’un singe rhésus en 1947 en Ouganda dans la forêt éponyme. Il a ensuite été isolé chez l’homme en 1952 en Ouganda et Tanzanie, et a plus récemment provoqué quatre grandes épidémies : sur l’île de Yap (Micronésie) en 2007, en Polynésie française en octobre 2013, en Nouvelle-Calédonie en janvier 2014 et au Brésil en mai 2015. Des souches asiatiques étaient à l’origine de ses quatre épidémies, qui ont eu lieu dans des zones géographiques où le virus n’avait jamais circulé auparavant, donc au sein de populations immunologiquement naïves.
En Micronésie, l’épidémie de 2007 de l’île de Yap a causé 5 000 infections. En 2013 et 2014, en Polynésie française, 55 000 cas de Zika ont été signalés puis l’épidémie s’est propagé ensuite dans d’autres îles du Pacifique et notamment, la Nouvelle-Calédonie, les îles Cook et l’île de Pâques.
Le virus Zika est détecté pour la première fois dans le Nord-Ouest du Brésil en mai 2015 et sa présence s’étend très rapidement pour atteindre le plus grand nombre de cas de Zika jamais décrit jusqu’à présent: entre 440 000 et 1 500 000 cas suspects ont été rapportés.
Depuis octobre 2015, le virus est présent en Colombie, Salvador, Guatemala, Honduras, Mexique, Panama, Paraguay, Surinam, Venezuela. Des cas ont été détectés en Guyane française, en Martinique et Guadeloupe. La Réunion et Mayotte n’ont pas rapporté de circulation à ce jour. Alors que les pays africains avaient été relativement épargnés, le Cap-Vert a connu une importante épidémie en 2015-2016 avec un vecteur génétiquement différent.
Au début de l’année 2016, le monde est en effervescence à propos du virus Zika. L’épidémie au Brésil et l’hypothèse d’une association possible avec des cas de microcéphalie sévère ont créé une alerte à tous les niveaux. L’OMS déclare alors, 1er février 2016, le problème comme «urgence de santé publique de portée internationale», comme le CovidCovid-19 Une maladie à coronavirus, parfois désignée covid (d'après l'acronyme anglais de coronavirus disease) est une maladie causée par un coronavirus (CoV). L'expression peut faire référence aux maladies suivantes : le syndrome respiratoire aigu sévère (SRAS) causé par le virus SARS-CoV, le syndrome respiratoire du Moyen-Orient (MERS) causé par le virus MERS-CoV, la maladie à coronavirus 2019 (Covid-19) causée par le virus SARS-CoV-2. le sera plus tard.
Un vecteur et des modes de transmission
Le mode de transmission principal du virus Zika est vectoriel. Le virus est transmis par les moustiques du genre Aedes qui sont aussi vecteurs des virus de la dengue et du Chikungunya. L’espèce Aedes aegytpi, responsable de l’épidémie au Brésil, est un moustique qui vit principalement dans des climats tropicaux. Son cycle de reproduction est urbain et sylvatique/sauvage.
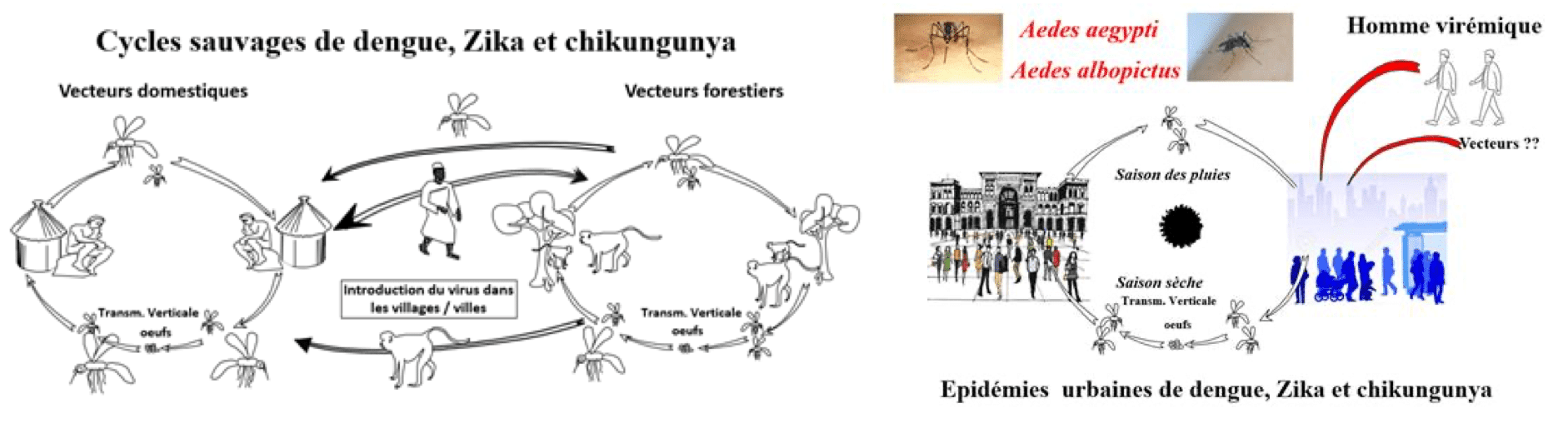
Source: Fontenille D. 2015. Histoire naturelle du chikungunya, de la dengue et de la fièvre Zika (du singe à l’homme). Les maladies infectieuses, de boeck solal.
Ces moustiques ne sont pas retrouvés à plus de 2000 mètres d’altitude. Contrairement au vecteur du paludisme, ils sont agressifs toute la journée et, pour ce qui est d’albopictus, associés aux eaux stagnantes. Certaines espèces comme le moustique Aedes albopictus (moustique tigre) sont présentes dans des zones plus tempérées d’Europe (voir figure ci-dessous) jusqu’au bois de Vincennes. La mairie de Paris a également signalé la présence du moustique tigre. (Il existe d’ailleurs un site pour signaler la présence du moustique tigre.)
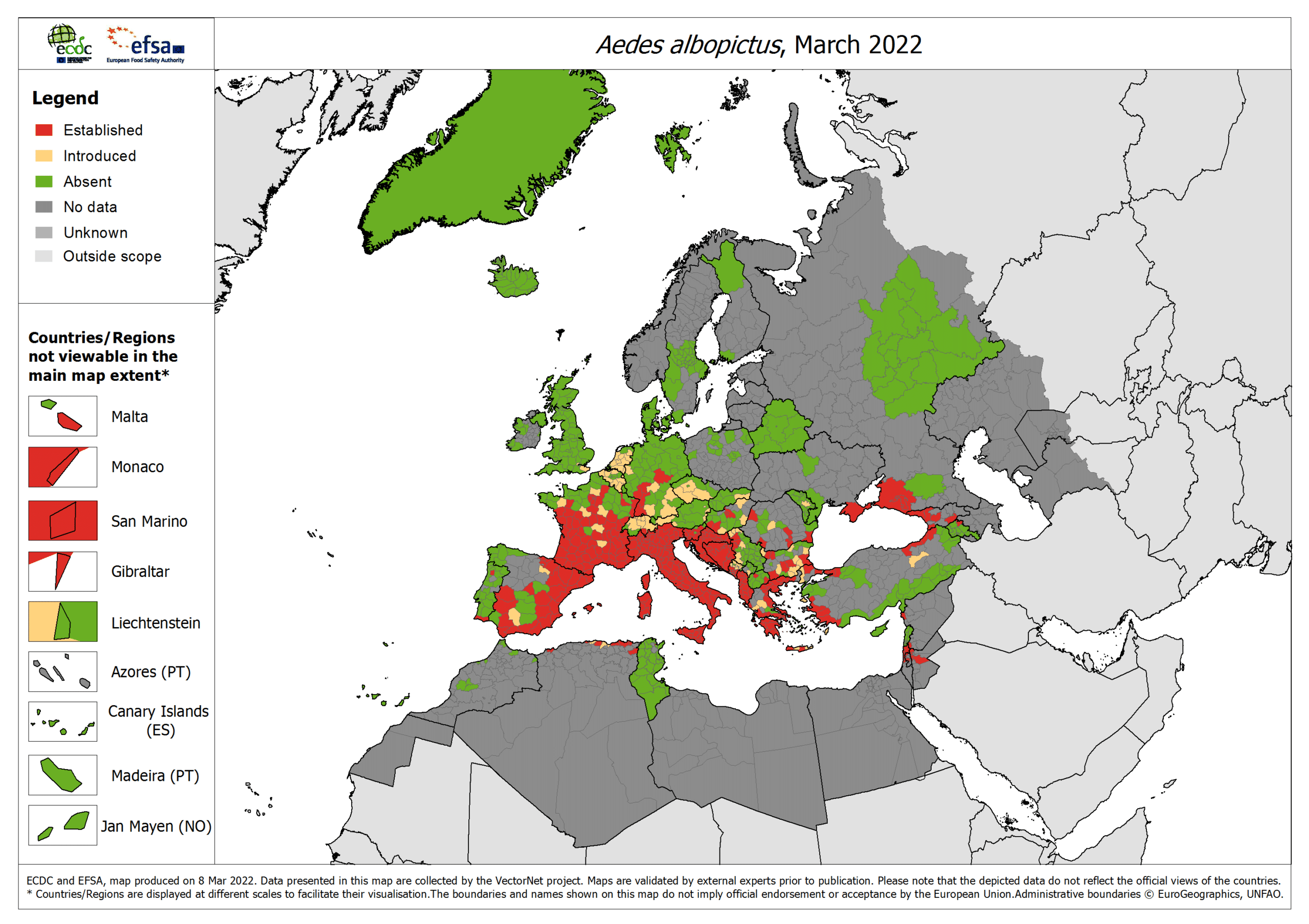
Source : ECDC.
Le moustique est infecté par le virus lors d’un repas sanguin quand il pique une personne porteuse du Zika. Le virus se multiplie au sein du moustique sans conséquence pour l’insecte. Puis, lors d’une prochaine piqûre, le moustique déverse le virus dans le sang d’une nouvelle personne. Durant la phase d’incubation, la personne peut être à l’origine de l’infection d’autres moustiques si elle se fait piquer à nouveau. C’est pourquoi les malades atteints du Zika doivent éviter d’être piqués afin d’interrompre le cycle de transmission virale. Enfin, aucun cas d’infection arbovirale post-transfusionnelle n’a été rapporté en France.
C’est une donnée clé de la diffusion : une personne malade revenant de zone d’endémie peut transmettre la maladie arbovirale soit directement, sexuellement, soit dès lors que le vecteur est présent. Ce qui est largement le cas pour le moustique-tigre qui sera bientôt présent sur tout le territoire français. Ce principe de diffusion secondaire à partir des cas importés à été largement démontré pour le Chikungunya en Italie.
Zika, comme Ébola, est donc désormais considéré aussi comme une maladie sexuellement transmissible. La transmission sexuelle du virus Zika lors de relations avec des partenaires infectés, est documentée depuis 2008. Durant l’épidémie au Brésil de 2015-2016, des cas ont été rapportés de transmissions d’homme à homme ou d’homme à femme et de femme à homme. La réplication virale a été mise en évidence dans le sperme et de l’ARN viral a été isolé jusqu’à six mois après le début des symptômes. Chez la femme, de l’ARN viral a été retrouvé dans les sécrétions vaginales et la glaire cervicale.
Des formes symptomatiques et d’autres asymptomatiques
Cliniquement, après une période d’incubation de 3 à 12 jours, on décrit des formes asymptomatiques fréquentes, des formes dengue like avec fièvre pendant 2 à 5 jours mais aussi des arthralgies, œdèmes des extrémités, fièvre modérée, céphalées, douleurs rétro-orbitaires, conjonctivite et éruption maculo-papuleuse prurigineuse, vertiges, myalgies, troubles digestifs, ictères. Jusqu’à l’épidémie au Brésil, on ne décrivait ni formes sévères, ni décès. Des cas de syndromes de Guillain-Barré, ces atteintes des nerfs périphériques qui peuvent conduire en réanimation, des complications auto-auto-immunes, des microcéphalies et des atteintes du nerf optique chez les bébés nés de mère infectée durant la grossesse ont été rapportés dès les épidémies.
Aux Antilles et en Guyane en 2016, le risque de malformation neurologique ou oculaire embryofoetale chez les femmes enceintes avec une infection à virus Zika symptomatique, était de 7% ; risque plus important lorsque l’infection survenait au premier trimestre de la grossesse.
Le rôle de l’environnement
Des facteurs environnementaux permettent, ou non, au potentiel vectoriel impliqué dans Zika de se développer. Selon Combes, la spécificité de l’interaction vecteur-pathogène passe par quatre étapes :
- coexister dans l’espace et le temps;
- se rencontrer (facteurs comportementaux);
- se reconnaître (spécificité, récepteurs);
- s’accepter (sensibilité, immunité).
Tous ces paramètres de la capacité vectorielle sont soumis à l’évolution génétique et à des pressions de sélection, et évoluent dans le temps et l’espace. Un excellent exemple est la récente pandémie de fièvre Zika, dont le virus a été transmis dans le monde entier par des populations très différentes d’Aedes aegypti toutes résistantes aux insecticides, ce qui en soit est une mauvaise nouvelle et appelle à la recherche d’autres outils de lutte antivectorielle sur lesquels nous reviendrons. Les populations invasives d’aegypti (en Amérique et Asie) se sont révélées de meilleurs vecteurs du virus Zika que les populations ancestrales d’Afrique.
Il n’existe ni traitement spécifique, ni vaccin mais plusieurs plateformes vaccinales possèdent des candidats vaccins anti Zika en développement. Plus de 50 candidats vaccins seraient en cours de développement.

A. Aedes (Stegomyia) albopictus, female ©Nil Rahola, IRD.
B. Hyalomma marginatum ©F Stachurski, CIRAD.
C. Culicoides nubeculosus, female ©JB Ferré, EID méditerranée.
D. Philaenus spumarius ©Jean-Yves Rasplus, INRAE.
Source.
Le rôle du changement climatique
Le sud de la France, comme le reste du monde, est confronté à l’émergence de maladies affectant les plantes, les animaux et les populations humaines, dont les agents étiologiques (virus, parasites, bactéries) sont transmis par des arthropodes vecteurs. Les changements globaux auxquels nous faisons face accélèrent l’apparition et la diffusion de ces pathologies. C’est le cas pour les vecteurs des virus de la fièvre jaune, de la dengue, de Zika, du chikungunya (Aedes aegypti et Ae.albopictus), de la fièvre de Crimée-Congo (Hyalomma marginatum), de la fièvre catarrhale ovine (Culicoides sp.) et de la bactérie phytopathogène Xylella fastidiosa (Hemiptera spp).
Comment un arthropode devient un vecteur en un lieu et à un moment donné? Pour Didier Fontenille, entomologiste, «Au-delà des lieux communs sur des phénomènes bien réels aux conséquences dramatiques tels que le changement climatique, les modifications de l’environnement, les changements de pratiques agricoles, l’urbanisation, l’intensification du commerce mondial, c’est souvent la conjonction d’un ensemble d’événements, la plupart du temps avec une faible probabilité d’occurrence, qui conduit à l’émergence de la transmission d’un agent pathogène par un vecteur, insecte, acarien, mollusque, nématode En d’autres termes, le pire n’est jamais sûr, mais c’est le pire qui retient notre attention en tant qu’humains, lorsque nous sommes directement concernés.»
Pour l’heure, Zika est peu apparent dans les cas importés d’arboviroses en France (n= 3). Louis Pasteur, Charles Nicolle et bien d’autres nous prédisaient que «le microbe n’est rien, le milieu est tout», préfigurant ainsi l’approche «One Health» qui devient aujourd’hui le paradigme dominant dans cette période post et per covid.
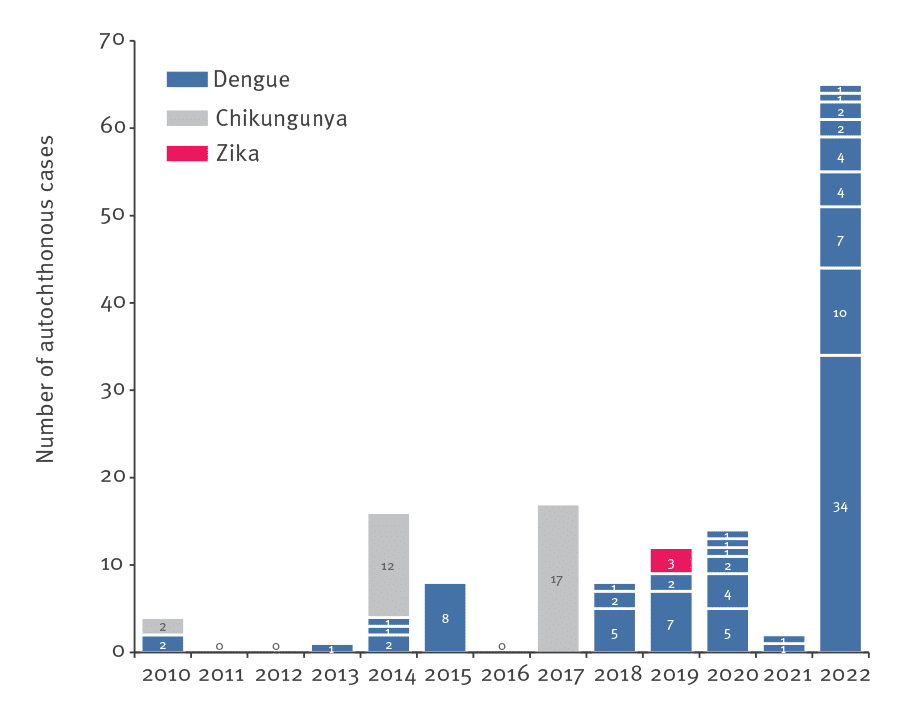
(Les données pour 2022 ne sont pas encore consolidées.)
Sources : Cochet Amandine, Calba Clémentine, Jourdain Frédéric, Grard Gilda, Durand Guillaume André, Guinard Anne, Investigation team, Noël Harold, Paty Marie-Claire, Franke Florian. Autochthonous dengue in mainland France, 2022: geographical extension and incidence increase. Euro Surveill. 2022;27(44):pii=2200818.
Références
- Fontenille D. et al, Comprendre le rôle des arthropodes vecteurs dans l’émergence et la propagation des maladies infectieuses végétales, animales et humaines. Chronique d’épidémies annoncées dans le sud de la France.
- Chikungunya, dengue et zika : Données de la surveillance renforcée en France métropolitaine en 2022;
- Prise en charge médicale des personnes atteintes par le virus Zika;
- Zika virus epidemiology in Bolivia: A seroprevalence study in volunteer blood donors; Saba Villarroel PM et al. (2018) PLoS Negl Trop Dis.. doi: 10.1371/journal.pntd.0006239;
- Netto, E. M. et al (2017). In A. M. Powers & J. M. Hughes (Eds.), mBio 8(6). American Society for Microbiology. Doi : 10.1128/mbio.01390-17;
- La fiche Zika sur le site de l’institut Pasteur.
