Deux accords commerciaux distincts ont en effet été conclus avec des fabricants de génériques indiens pour autoriser la production et la distribution du traitement en prophylaxie pré-exposition (PrEP) au prix de 40 dollars ou 34 euros par an : Unitaid, la Clinton Health Access Initiative (CHAI) et Wits RHI avec le fabricant Dr. Reddy’s, et la Fondation Gates avec Hetero Labs.
Ce tarif compétitif rapproche le prix de ce traitement constitué de deux injections par an de celui de la PrEPPrEP Prophylaxie Pré-Exposition. La PrEP est une stratégie qui permet à une personne séronégative exposée au VIH d'éliminer le risque d'infection, en prenant, de manière continue ou «à la demande», un traitement anti-rétroviral à base de Truvada®. générique en version orale. Cette annonce est l’aboutissement de plusieurs mois de négociation sous la pression des institutions internationales et des associations de lutte contre le sidaSida Syndrome d’immunodéficience acquise. En anglais, AIDS, acquired immuno-deficiency syndrome. (voir notre article : Lénacapavir: accès global ou licences volontaires?).
Aux États-Unis, le lénacapavir est commercialisé à 28218 dollars par an par Gilead, le laboratoire qui a développé le traitement. Dès juin 2025, l’Onusida exhortait Gilead à baisser le prix de son nouveal injectable contre le VIH, citant des études estimant que le lénacapavir générique pourrait être produit pour un coût entre 35 et 46 dollars par an et par personne.
Les pays concernés sont ceux inclus dans les accords de licence volontaire libres de droits signés par Gilead avec six fabricants de génériques en octobre 20241Afghanistan, Angola, Anguilla, Antigua and Barbuda, Armenia, Aruba, Azerbaijan, Bahamas, Bangladesh, Barbados, Belarus, Belize, Benin, Bhutan, Bolivia, Botswana, British Virgin Islands, Burkina Faso, Burundi, Cabo Verde, Cambodia, Cameroon, Central African Republic, Chad, Comoros, Congo, Dem. Rep. of the, Congo, Rep, Cote d’Ivoire, Cuba, Djibouti, Dominica, Dominican Republic, Egypt, Equatorial Guinea, Eritrea, Eswatini, Ethiopia, Fiji, Gabon, Gambia, Georgia, Ghana, Grenada, Guinea, Guinea-Bisau, Guyana, Haiti, Honduras, India, Indonesia, Jamaica, Kazakhstan, Kenya, Kiribati, Kyrgizstan, Lao, People’s Dem. Rep, Lesotho, Liberia, Libya, Madagascar, Malawi, Maldives, Mali, Marshall Islands, Mauritania, Mauritius, Micronesia, Fed. Sts., Moldova, Mongolia, Montserra, Morocco, Mozambique, Myanmar, Namibia, Nauru, Nepal, Nicaragua, Niger, Nigeria, North Korea – DPR, Pakistan, Palau, Papua New Guinea, Philippines, Rwanda, Saint Kitts and Nevis, Saint Lucia, Saint Vincent and the Grenadines, Samoa, Sao Tome and Principe, Senegal, Seychelles, Sierra Leone, Solomon Islands, Somalia, South Africa, South Sudan, Sri Lanka, Sudan, Suriname, Syrian Arab Republic, Tajikistan, Tanzania, Thailand, Timor-Leste, Togo, Tonga, Trinidad and Tobago, Tunisia, Turkmenistan, Turks and Caicos Islands, Tuvalu, Uganda, Ukraine, Uzbekistan, Vanuatu, Vietnam, Yemen, Zambia, Zimbabwe..
Une efficacité sans précédent en PrEP
En juillet 2025, le Dr Tedros Adhanom Ghebreyesus, directeur général de l’OMS, déclarait: «La mise au point d’un vaccin contre le VIHVIH Virus de l’immunodéficience humaine. En anglais : HIV (Human Immunodeficiency Virus). Isolé en 1983 à l’institut pasteur de paris; découverte récemment (2008) récompensée par le prix Nobel de médecine décerné à Luc montagnier et à Françoise Barré-Sinoussi. reste une quête incertaine, mais le lénacapavir est ce qui s’en rapproche le plus dans la mesure où il s’agit d’un antirétroviral à action prolongée dont il a été démontré, dans les essais cliniques, qu’il prévient la quasi-totalité des infections à VIH chez les personnes exposées.»
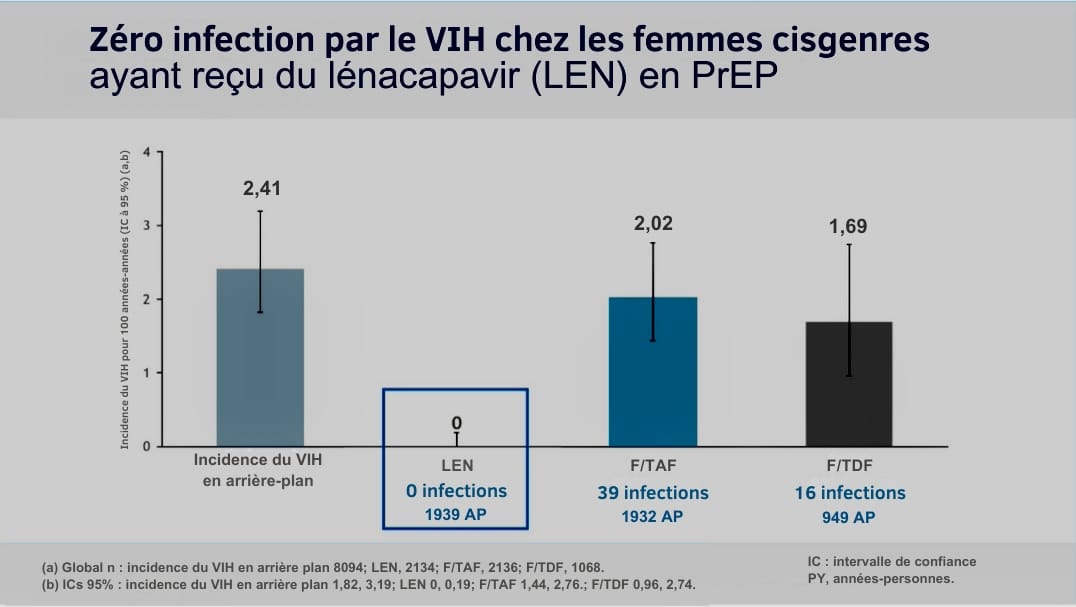
Il faut dire que les résultats des deux premières études PURPOSE, qui évaluaient l’efficacité et la sécurité du lénacapavir en PrEP injectable, sont impressionnants: 100% de protection contre la transmission du VIH chez les femmes cisgenres, et 96% chez les hommes ayant des rapports sexuels avec d’autres hommes (HSH) et les femmes transgenres. Les chercheurs avaient d’ailleurs interrompu PURPOSE 1 avant son terme, pour mettre l’injectable à disposition de toutes les participantes.
L’application de ces accords interviendra seulement deux ans après l’autorisation de mise sur le marché de la molécule aux États-Unis et dans l’Union européenne (respectivement en juin et en août 2025). Cette annonce relance l’espoir de voir de nouveaux d’outils être mis à la disposition des populations exposées face au VIH et de mettre enfin fin à la transmission du VIH. Dans le difficile contexte politique et financier actuel, la promesse de réalisation de cet objectif, fixé à 2030 par l’OMS et l’ONUSIDA, ne cesse de s’éloigner. En 2024, 1,3 million de personnes ont été infectées par le VIH, et seulement 18% des personnes susceptibles de bénéficier de la PrEP y ont actuellement accès.
Lénacapavir en PrEP : Pas encore en France
Le lénacapavir est commercialisé en France depuis 2022, sous le nom de Sunlenca®, mais pas pour la PrEP : il est réservé pour l’instant2A date, en octobre 2025 au traitement des personnes en échec thérapeutique infectées par une souche multirésistante. En août 2025, le lénacapavir a reçu un avis favorable du Committee for Medicinal Products for Human Use (CHMP) de l’Agence européenne du médicament (EMA) concernant son autorisation de mise sur le marché (AMM). La version définitive doit maintenant être examinée par la Commission européenne. C’est seulement alors que la France, via la commission de la transparence de la Haute autorité de Santé (HAS), pourra évaluer l’intérêt du médicament dans le cadre de cette nouvelle utilisation et négocier son prix.
