Rien de très nouveau pour Vih.org, mais une belle synthèse sur les apports de ces nouveaux traitements et une question épineuse: quid de ceux qui échappent virologiquement, 1% environ, avec une très large résistance.
Alors que les traitements antirétroviraux (ART) réussissent à supprimer la charge viraleCharge virale La charge virale plasmatique est le nombre de particules virales contenues dans un échantillon de sang ou autre contenant (salive, LCR, sperme..). Pour le VIH, la charge virale est utilisée comme marqueur afin de suivre la progression de la maladie et mesurer l’efficacité des traitements. Le niveau de charge virale, mais plus encore le taux de CD4, participent à la décision de traitement par les antirétroviraux. avec de moins en moins de comprimés, une seule fois par jour, et beaucoup moins d’effets secondaires que les premiers traitements, qui rendent à nouveau la médecine triomphante après la descente aux enfers 1982-1996, quels problèmes ne sont pas encore réglés?
Pedro Cahn, de l’Hôpital Juan Fernandez de Buenos Aires, qui a présidé un temps l’IAS, les a listés : stigmatisation associée à la prise de médicaments, surtout pour les jeunes qui parfois se cachent, dans leur famille ou à leur travail, pour prendre leurs médicaments, ont peur d’être découverts (séropositif) ! Parfois, difficulté à avaler les grosses pilules ! Impact psychologique lié à la prise quotidienne (angoisse de savoir si on les a pris ou pas) et d’avoir une maladie incurable, à traiter à vie, risques de sauter des prises, difficultés de maintenir les prises en voyage, en week-end, arrêt des traitements pour n’importe quelle raison (opération chirurgicale, rupture d’approvisionnement…), tant de raisons qui font sourire quand on a connu les années d’avant les trithérapies, mais qui sont la source de mauvaise adhérence au traitement et finalement d’échec. 43,1% des patients interrogés (N=2 389), mettent en première ou deuxième priorité d’avoir accès à des traitements à longue durée de manière à ne pas être obligés de prendre des médicaments tous les jours.
Un autre sujet de préoccupation concerne les interactions entre les différents traitements, les problèmes d’absorption qui n’existent pas ou moins pour les formes injectables.
L’avenir de la trithérapie est la bithérapie
Pour Pedro Cahn, l’avenir de la trithérapie est plutôt la bithérapie, soit par voie orale, dolutégravir/3TC, dolutégravir/rilpivirine, soit sous forme injectable : cabotégravir/rilpivirine, doravirine/islatravir, lénacapavir/bictégravir, lénacapavir/islatravir, lénacapavir/b-Nabs, ….
Avec peut-être aussi des formes orales à prendre une fois par semaine ! Et, bien sûr pour toutes ces nouvelles spécialités, la question du prix et la mise à disposition dans les pays du Sud, qui relèvent de choix économiques et politiques.
Monica Ganda, directrice du service 86 de San Francisco, a présenté une revue des études cliniques. Pour la combinaison cabotégravir/rilpivirine (CAB/RPV), la plupart des études ont concerné des patients préalablement traités par ART orale. L’étude FLAIR chez les patients naïfs, mais traités préalablement par injectable et par une combinaison DGT/RPV/3TC per os pendant 20 semaines. L’étude ATLAS, CAB/RPV toutes les 4 semaines chez des patients indétectables depuis au moins 6 mois, ATLAS 2M pour une population identique, mais toutes les 8 semaines. L’étude CARES, CAB/RPV toutes les 8 semaines en Ouganda, Kenya et Afrique du Sud chez des patients sous ART oral. Avec, pour toutes les études, d’excellents résultats chez la plupart des patients et un taux d’échec virologique très bas lié à l’apparition d’une résistance dans 0,7 à 2,3% selon les études. Et Monica Gandhi de conclure : « You fail rarely but when you fail, you fail hard ! » Une autre étude (IMPAACT 2017/MOCHA chez des adolescents aux États-Unis, Ouganda, Botswana et Afrique du Sud et Thaïlande (N=140) n’a retrouvé, elle, aucun échec virologique et 100% de suppression de la charge virale.
Des switchs positifs
Monica Gandhi a aussi présenté une étude toujours en cours dans son centre à San Francisco au sein d’une population de 370 personnes séropositives pus ou moins marginalisées (46% d’usagers de drogues, 40% sans domicile stable), un tiers avait une charge virale >50 copies/ml. Après le switch, les patients étaient vus au centre deux fois/semaine. À la 48e semaine, 99,4% de ceux qui ont commencé avec une charge virale indétectable étaient toujours virologiquement contrôlés, mais 97,9% de ceux qui avaient une charge virale détectable au début de l’étude étaient contrôlés (différence non significative entre les deux groupes).
Dans une méta-analyse parue dans le CID en décembre 2024, sur 32 études (N=9 224) avec le cabotégravir injectable, 1% d’échec virologique est retrouvé dans les études où les patients avaient une charge virale indétectable au moment du switch, et 5% quand le switch est fait alors que la charge virale est détectable.
Les guidelines de l’IAS-USA et du ministère de la Santé américain (DHHS) ont été modifiées en 2024 pour recommander l’utilisation des long acting (CABO/RPV) chez les patients qui ont une virémie persistante sous traitement oral malgré un «support intensif», après une décision commune du patient et du médecin, en étant conscient du risque de résistance qui limite les choix de traitement ultérieur et qui peut occasionner des contaminations.
Autres ART injectables
Le lénacapavir (LEN) est l’autre antirétroviral injectable disponible, un inhibiteur de capside qui agit à plusieurs niveaux de la réplication, extrêmement puissant, qui peut être administré en sous-cutané toutes les 26 semaines. Des essais pour le traitement sont en cours, qui associent LEN 2 fois/an et CABO toutes les 8 semaines (étude CAPELLA), un nouvel exemple de collaboration à saluer entre deux industriels.
D’autres associations sont prometteuses, Islatravir (inhibiteur de la reverse transcriptase 2mg/lénacapavir (capside inhibiteur) 300 mg par voie orale une fois/semaine qui va passer en phase 3.
En prévention (PrEP), le cabotégravir injectable (600 mg IM) toutes les 8 semaines est 66% plus efficace à 3 ans que l’association orale ténofovir/FTC dans une étude chez les HSHHSH Homme ayant des rapports sexuels avec d'autres hommes. et transgenres (N=4566) (Landovitz. NEJM 2021)
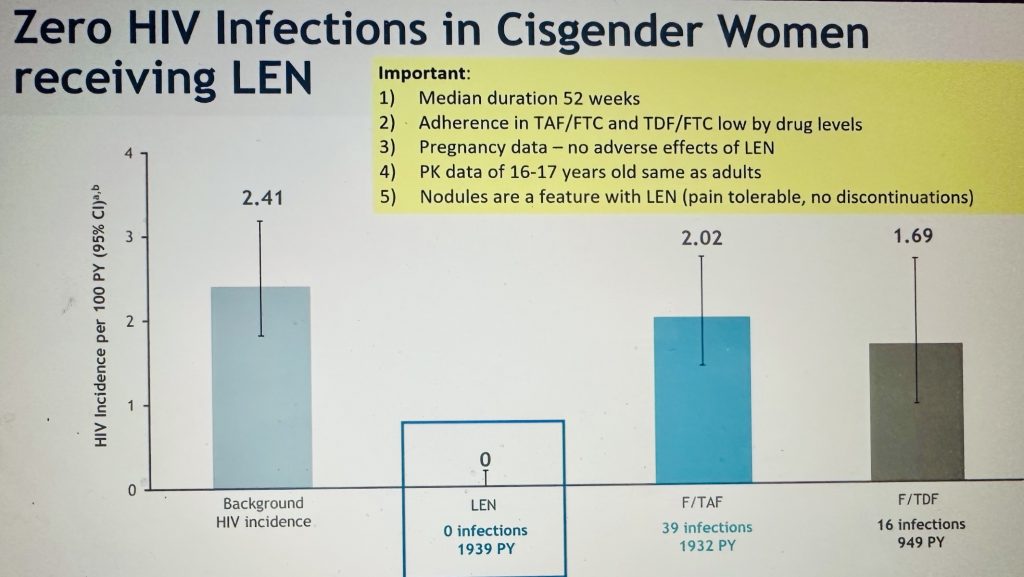
Enfin, le lénacapavir injectable deux fois/an (N=2134) en prévention se montre plus efficace que l’association F/TAF (N=2136) ou F/TDF (N=1068) dans l’étude PURPOSE 1 chez des jeunes femmes (16-18 ans) en Afrique du Sud et Ouganda. Durée médiane de 52 semaines. Zéro contamination dans le bras LEN, 39 dans le bras F/TAF (2.02%), 16 dans le bras F/TDF (1.69%). L’étude PURPOSE 2 chez des hommes et Transgenre (Kelly NEJM 2024) donne des résultats similaires.

Quand on sait, comme le rappelle Monica Gandhi, qu’il y a plus de 40 millions de personnes vivant avec le VIHVIH Virus de l’immunodéficience humaine. En anglais : HIV (Human Immunodeficiency Virus). Isolé en 1983 à l’institut pasteur de paris; découverte récemment (2008) récompensée par le prix Nobel de médecine décerné à Luc montagnier et à Françoise Barré-Sinoussi. dans le monde, 1,3 million de nouvelles infections en 2024 (inchangé par rapport à 2022), 630 000 morts/an (comme en 2022) et seulement 77% sous ART (et 72% virologiquement contrôlés), disposer de nouveaux traitements plus efficaces, particulièrement en prévention apparait comme une arme supplémentaire pour parvenir aux objectifs 95.95.95 en 2030, malgré l’incertitude sur les financements dans ces temps mouvementés.