Jusqu’à présent, seules deux personnes ont été déclarées guéries de leur infection par le VIHVIH Virus de l’immunodéficience humaine. En anglais : HIV (Human Immunodeficiency Virus). Isolé en 1983 à l’institut pasteur de paris; découverte récemment (2008) récompensée par le prix Nobel de médecine décerné à Luc montagnier et à Françoise Barré-Sinoussi. La première, connue en tant que «patient de Berlin» puis sous son vrai nom Timothy Ray Brown, ne présente plus de traces de présence du VIH dans le corps depuis 13 ans. Le deuxième cas, surnommé le «patient de Londres», n’a toujours pas de virus détectable dans son corps après trois ans de traitement antirétroviral.
Dans ces deux cas, les patients avaient reçu une greffe de moelle osseuse suite respectivement à une leucémie et un lymphome, et après avoir reçu une chimiothérapie pour éliminer leurs cellules immunitaires cancéreuses. Les cellules souches provenaient d’un donneur présentant une mutation génétique rare connue sous le nom de CCR5-delta-32, qui empêche le VIH d’infecter les cellules CD4.
L’étude SPARC-7
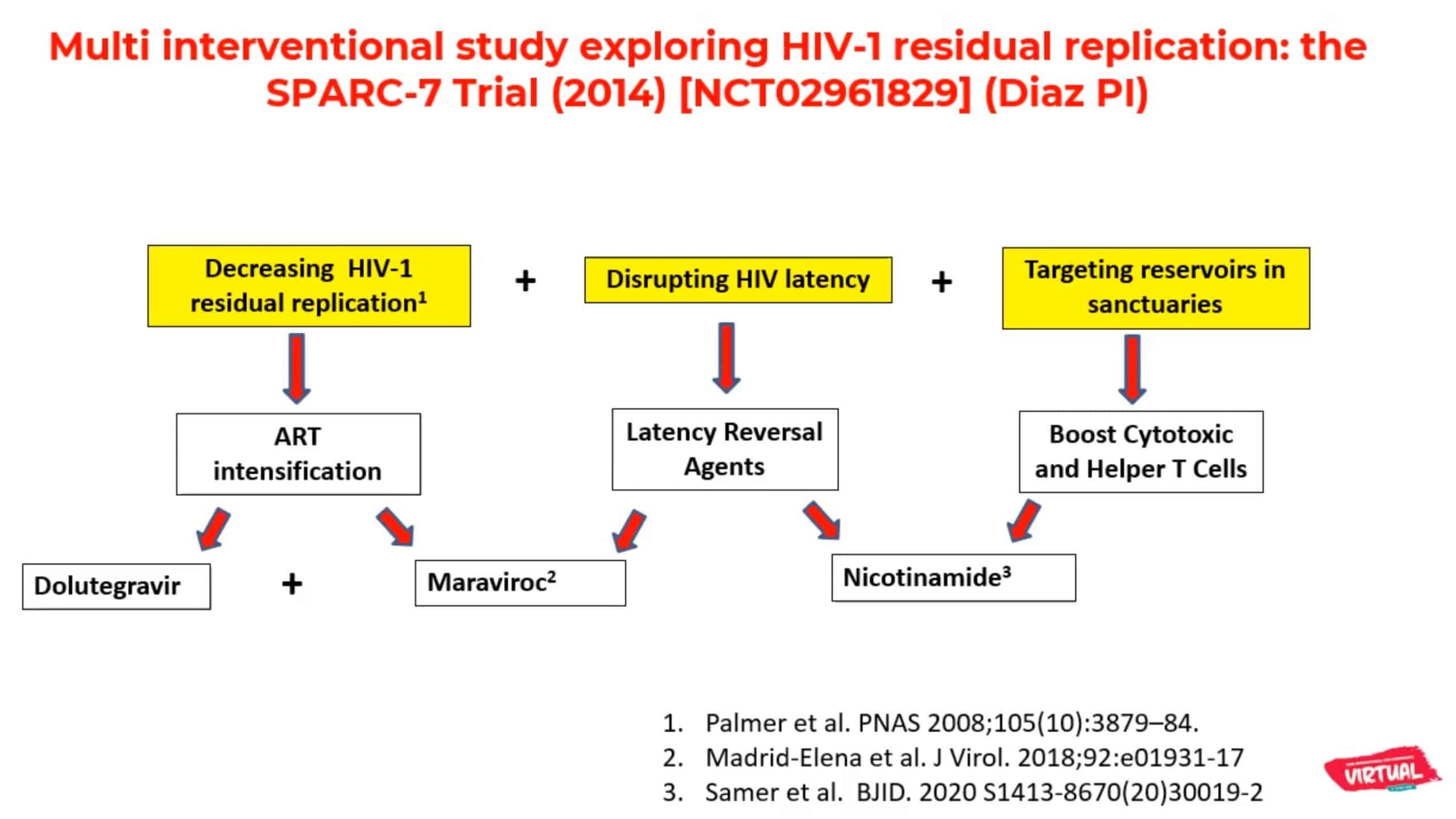
Le Dr Ricardo Diaz de l’Université de São Paulo au Brésil a présenté ce cas à la conférence virtuelle AIDS 2020. Le patient faisait partie de la cohorte de l’essai SPARC-7 qui visait à réduire la taille des réservoirs du VIH, grâce à différentes combinaisons d’ARV. Les participants étaient des adultes séropositifs qui en étaient à leur premier traitement antirétroviral, avec une charge viraleCharge virale La charge virale plasmatique est le nombre de particules virales contenues dans un échantillon de sang ou autre contenant (salive, LCR, sperme..). Pour le VIH, la charge virale est utilisée comme marqueur afin de suivre la progression de la maladie et mesurer l’efficacité des traitements. Le niveau de charge virale, mais plus encore le taux de CD4, participent à la décision de traitement par les antirétroviraux. indétectable depuis plus de deux ans et avec un nadirNadir Chiffre indiquant la valeur minimale enregistrée de la charge virale ou des CD4. de CD4 supérieur à 350 cellules/mm3.
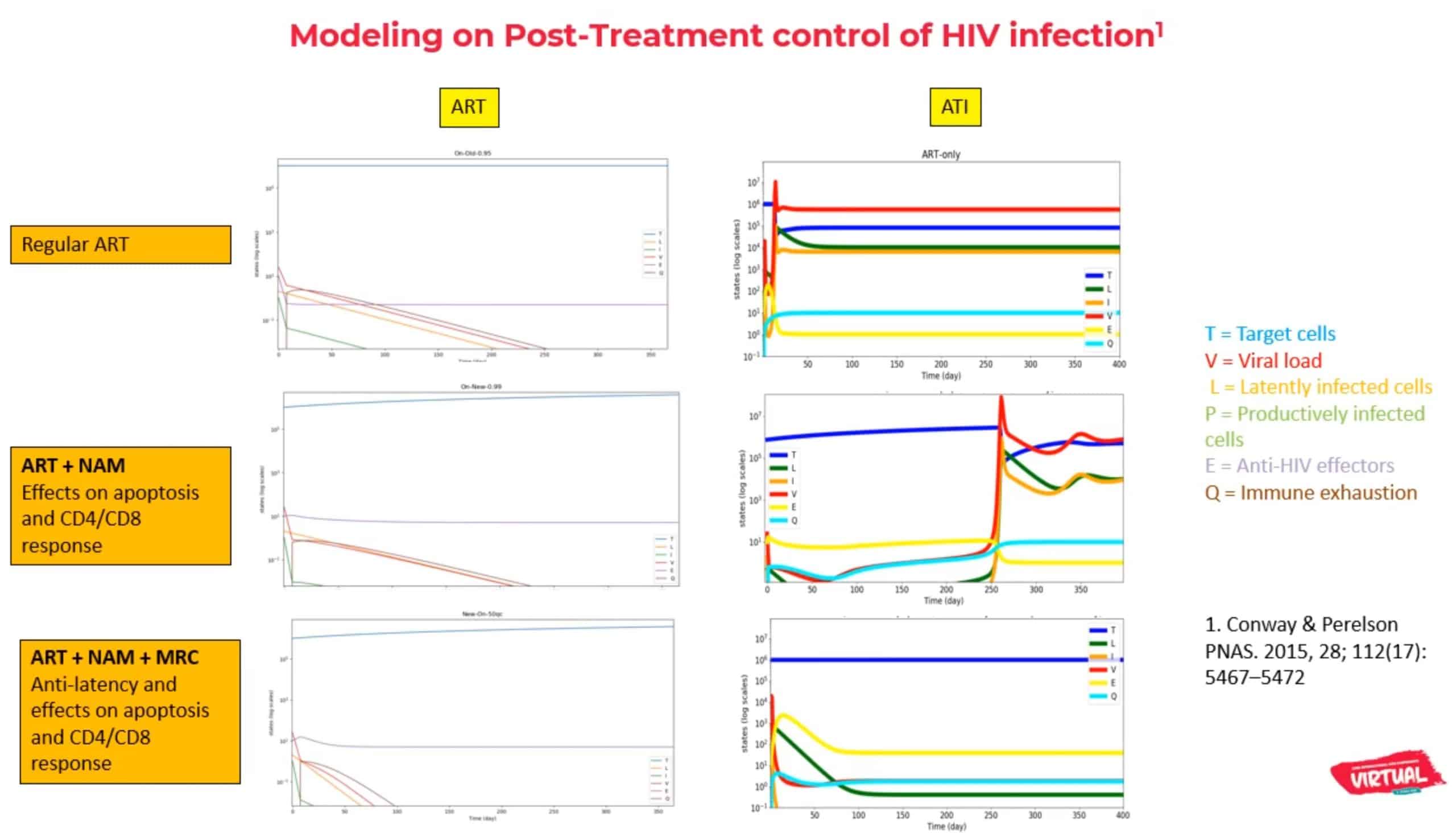
Le patient brésilien de 35 ans qui semble aujourd’hui en rémission est séropositifSéropositif Se dit d’un sujet dont le sérum contient des anticorps spécifiques dirigés contre un agent infectieux (toxo-plasme, rubéole, CMV, VIH, VHB, VHC). Terme employé, en langage courant, pour désigner une personne vivant avec le VIH. depuis octobre 2012. Son taux de CD4 était alors à son plus bas enregistré (372 cellules / mm3) et sa charge virale était de plus de 20000 copies/mL. Il a bénéficié d’un traitement deux mois plus tard, à base de composé d’efavirenz (Sustiva®), de zidovudine (AZT) et de lamivudine (3TC). En 2014, l’AZT a été remplacé par le ténofovir disoproxil fumarate (TDF).
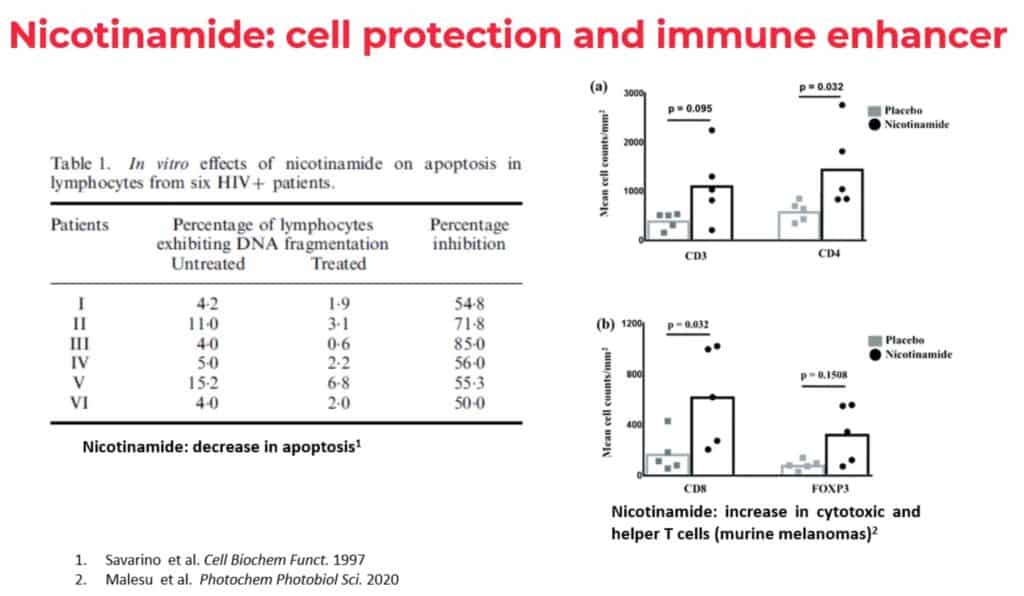
Pendant l’essai, le patient et 4 autres participants ont reçu deux ARV supplémentaires, l’inhibiteur d’intégrase dolutégravirDolutégravir Le dolutégravir, nom de marque de Tivicay® et présent dans Juluca® et Triumeq®, appartient à la une classe de médicaments antirétroviraux appelés inhibiteurs de l'intégrase. Il est utilisé en combinaison avec d'autres médicaments anti-VIH. (Tivicay®) et l’inhibiteur d’entrée maraviroc (Celsentri®), en plus de leur trithérapie habituelle, deux fois par jour pendant 48 semaines. En complément, ces cinq patients ont reçu 500 mg de nicotinamide, une forme soluble dans l’eau de la niacine, la vitamine B3. Le nicotinamide est utilisé pour le VIH par de multiples mécanismes. Disponible sous forme de supplément oral peu coûteux, le nicotinamide est actuellement à l’étude comme traitement anticancéreux en raison de ses propriétés immunostimulantes.
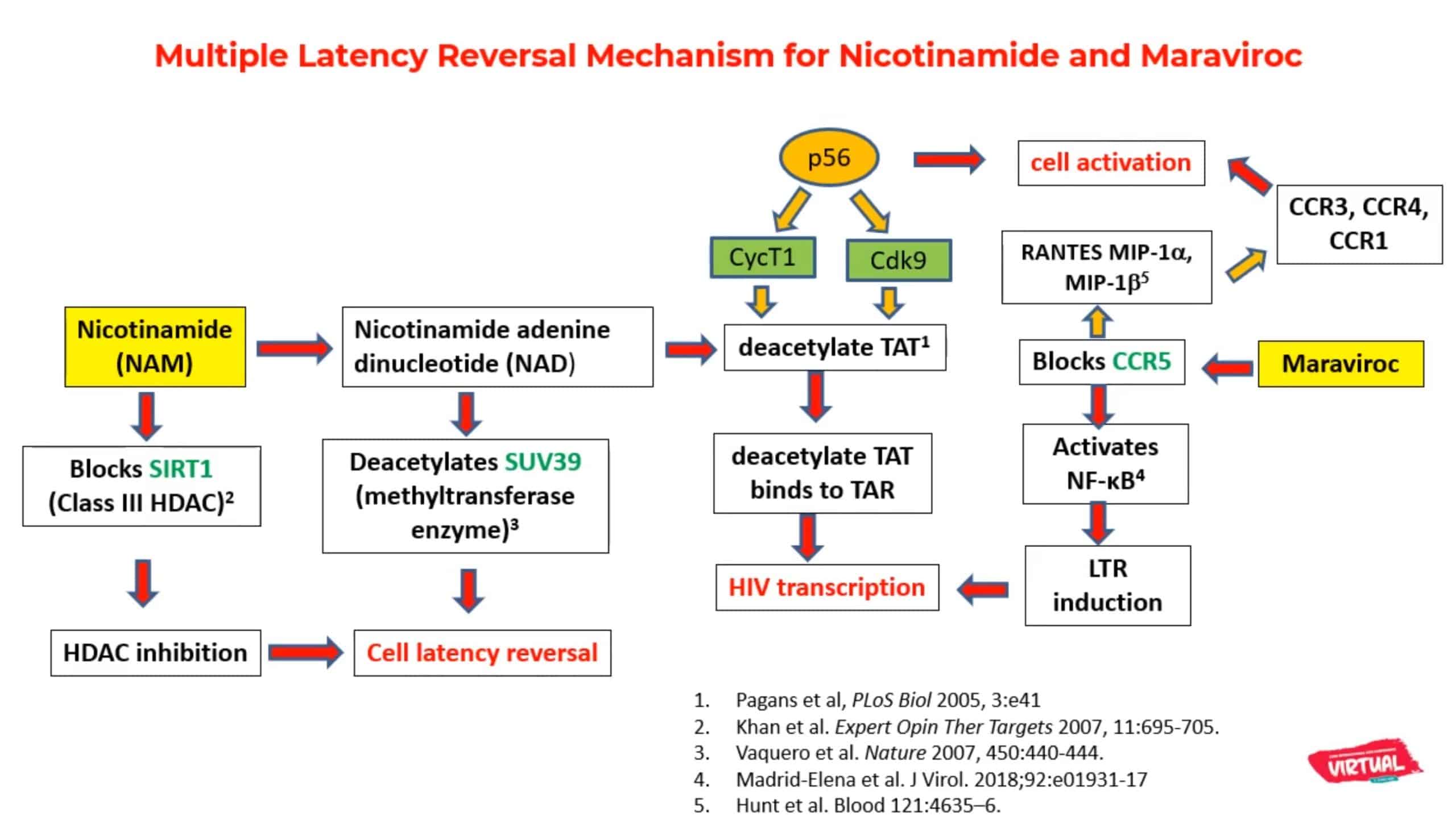
Mécanismes d’inversion de la phase de latence cellulaire
avec le Nicotinamide et le Maraviroc. DR
Les participants sont ensuite revenus à leur protocole de traitement ARV habituel, avant d’interrompre complètement leur traitement sous étroite surveillance.
L’homme s’est inscrit à l’essai clinique en septembre 2015 et a commencé le schéma thérapeutique intensifié avec nicotinamide. A la fin de l’essai, les quatre autres personnes de l’étude n’ont pas connu de rémission fonctionnelle.
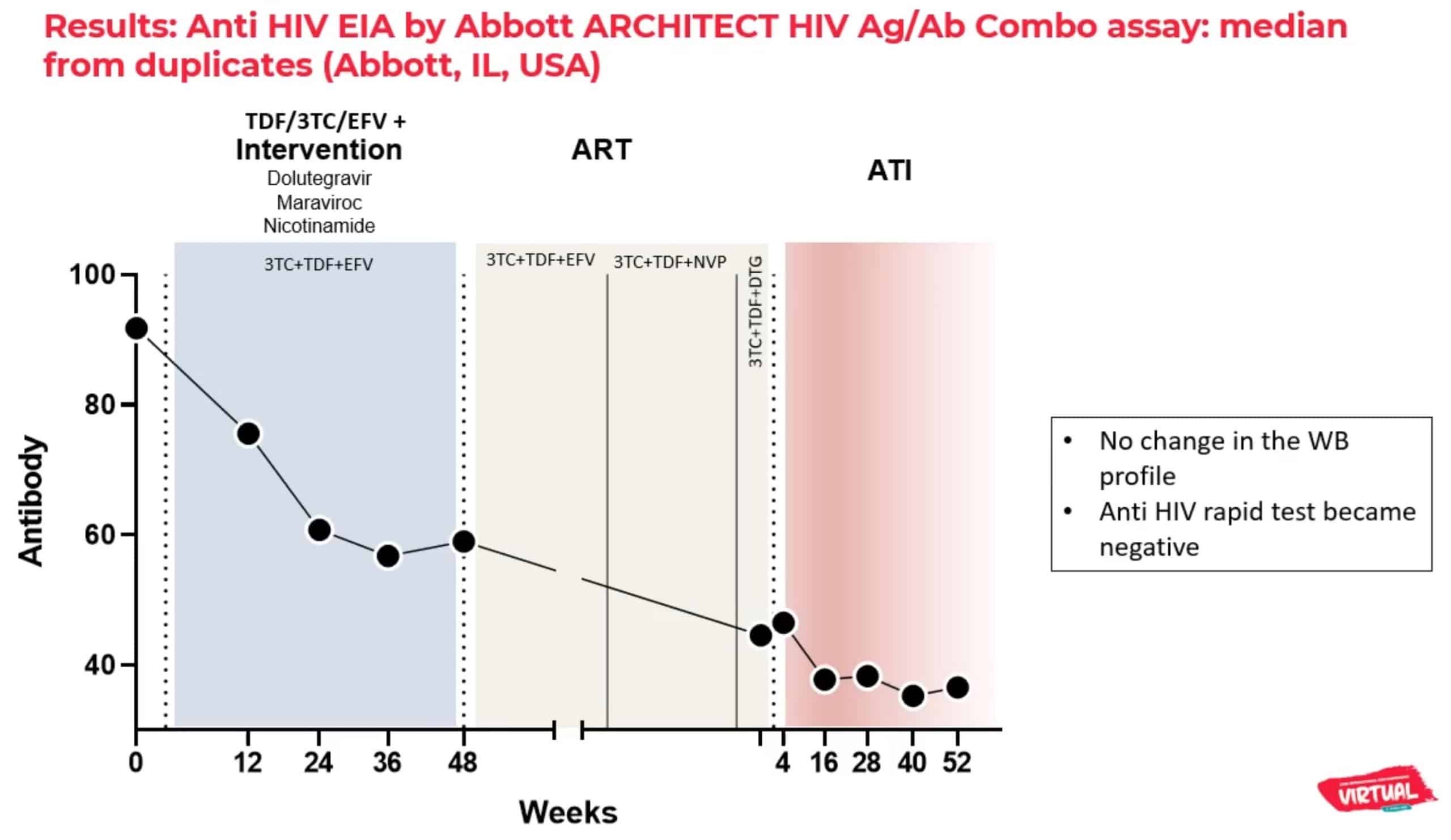
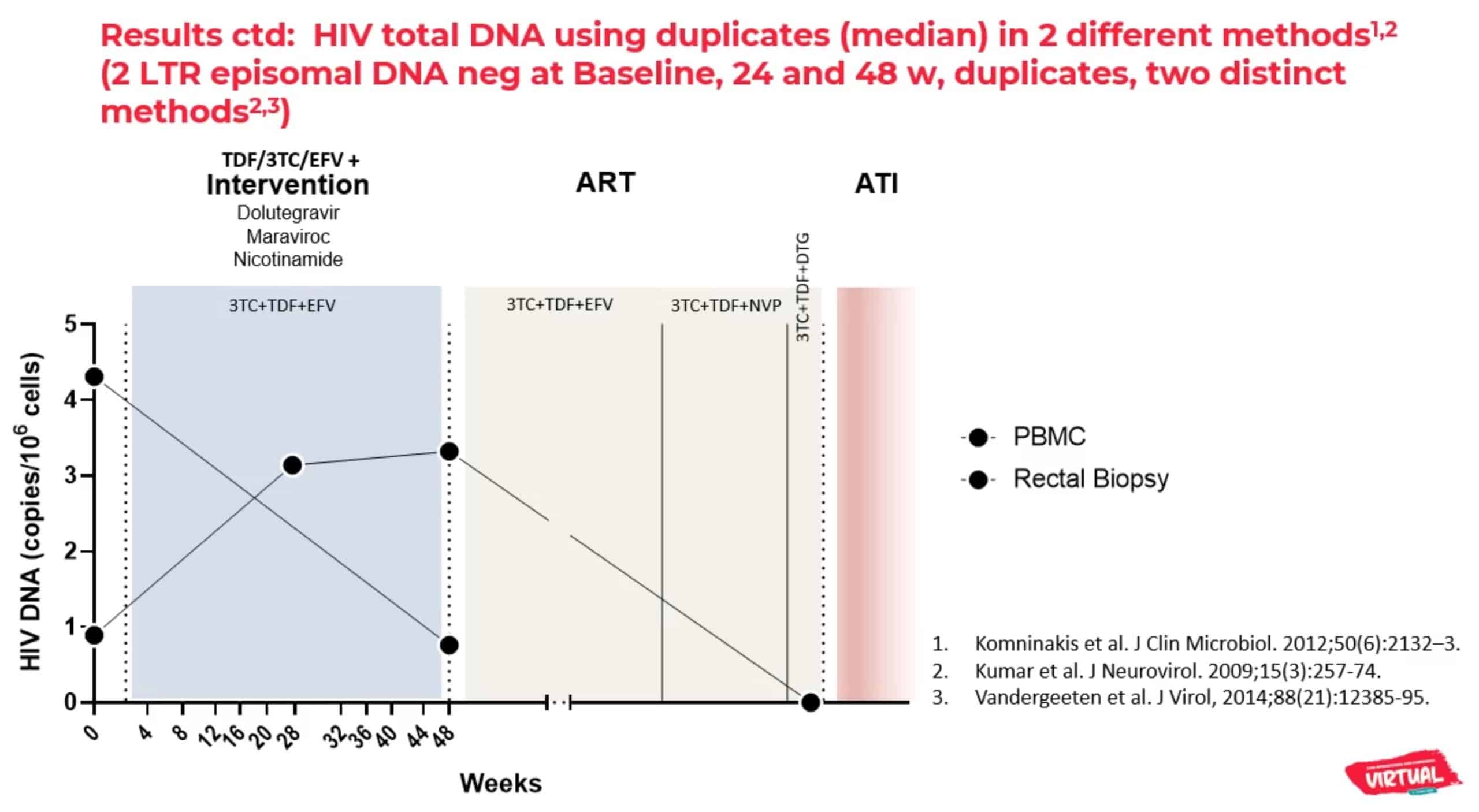
Le patient en rémission est le seul parmi les 30 participants totaux de l’étude à avoir connu des pics de réplication virale de bas niveau pendant son traitement expérimental (aux semaines 16 et 24), mais il est le seul dont la charge virale est restée indétectable par la suite, et chez qui aucune trace d’ADN du VIH n’est détectable dans les cellules mononuclées du sang périphérique (PBMC).
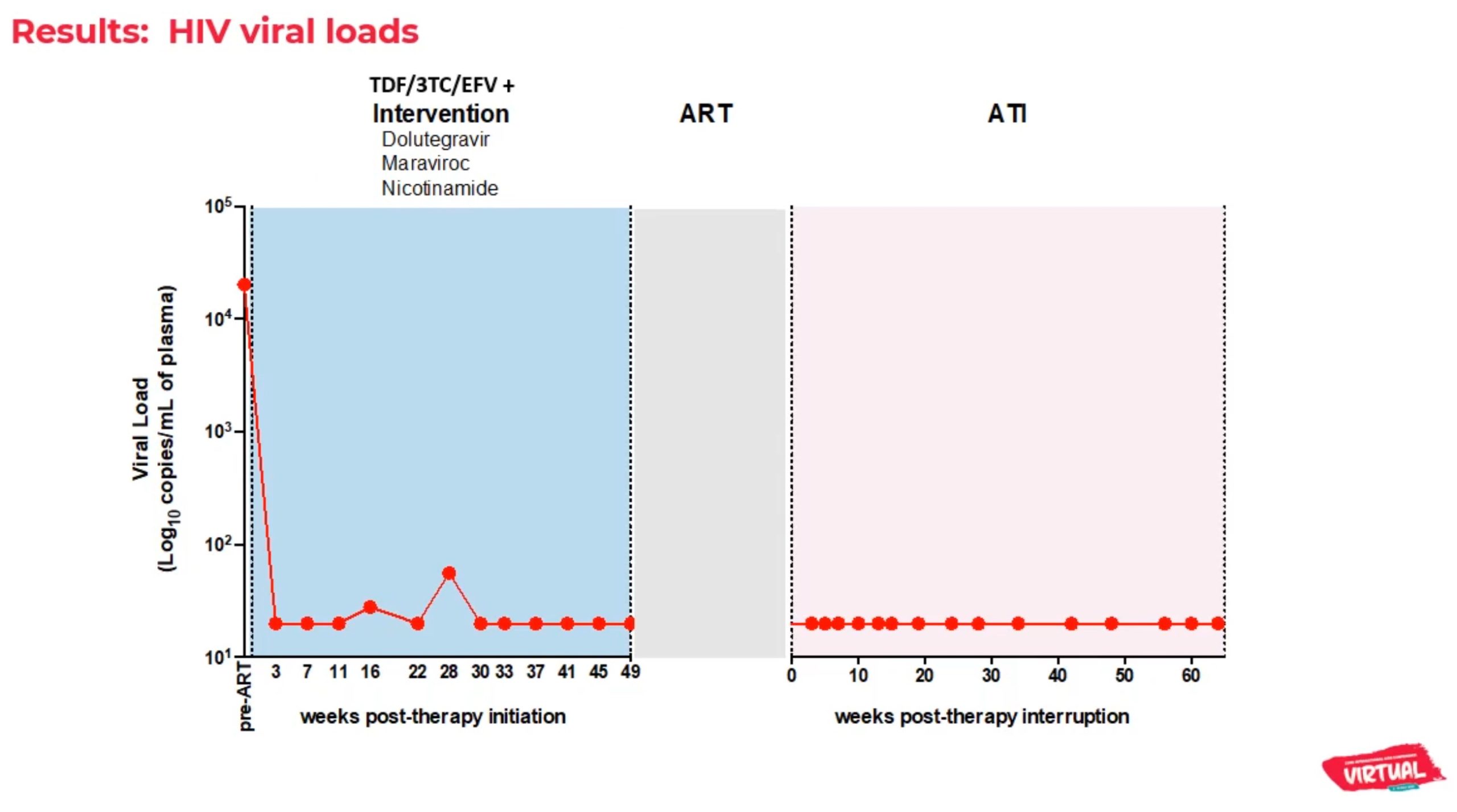
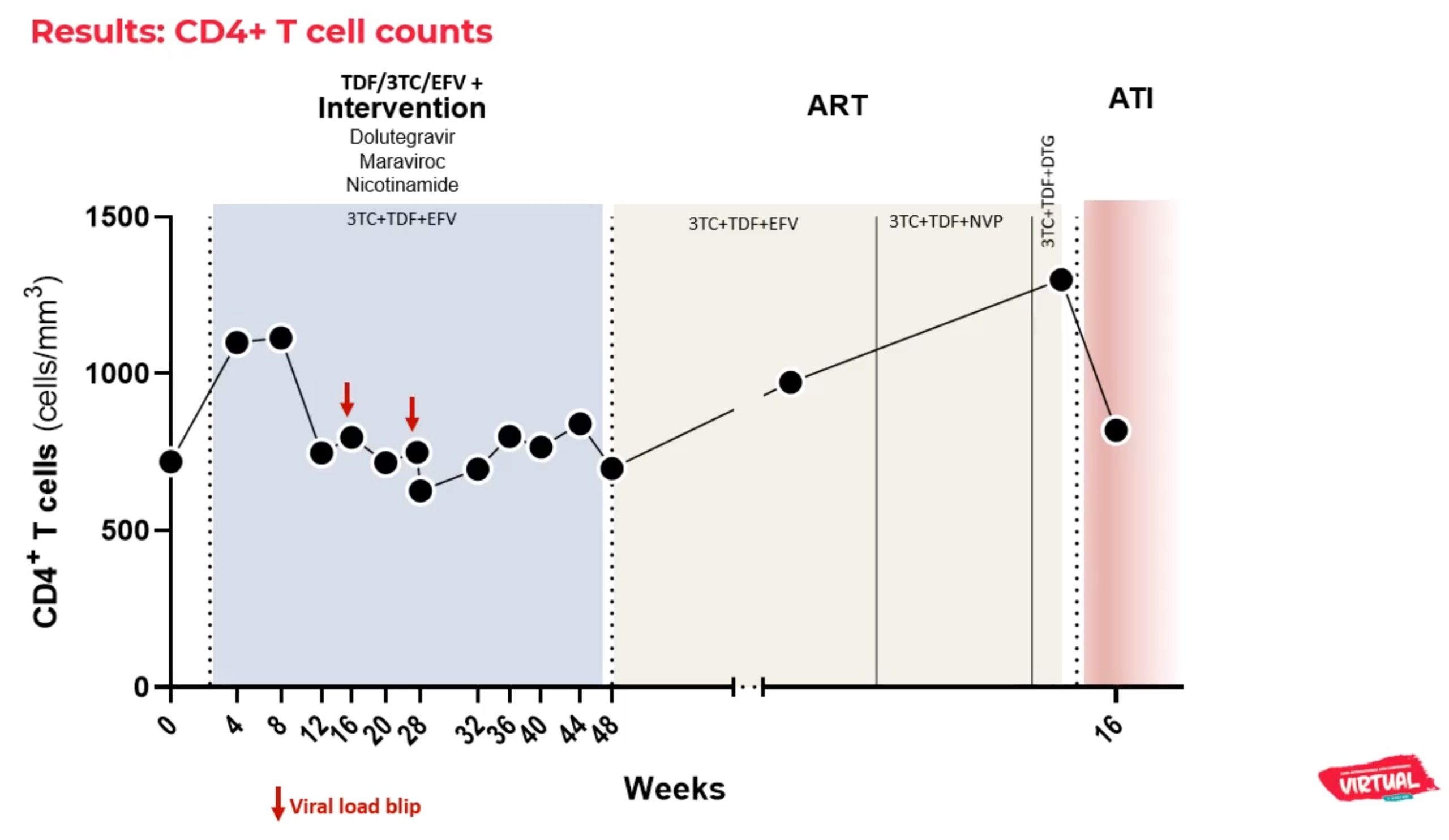
Encore une fois, difficile de parler de guérison si tôt, on a vu le virus réapparaitre jusqu’à 2 ans après la rémission dans des cas directement comparables. Et les causes de cette rémission ne sont pas encore connues. Nous ne pouvons pas encore parler d’un cas de guérison.
Un cas de contrôleur après traitement ?
Ce cas rappelle ceux de l’étude ANRS iVISCONTI, qui s’est appuyée sur les prélèvements réalisés sur des patients infectés par le VIH contrôlant l’infection plusieurs années après l’interruption du traitement antirétroviral. Les chercheurs ont observé dans leurs cellules des formes virales archivées intactes, donc capables de se répliquer, en proportion et en quantité équivalentes à celles observées chez les personnes toujours sous traitement antirétroviral initié dès le début de l’infection ou chez les sujets contrôlant naturellement l’infection. Les scientifiques en ont donc conclu que la rémission est donc possible chez certains individus infectés par le VIH pendant de longues périodes de temps (11,8 années en médiane dans cette étude) malgré la présence de virus génétiquement intact.
Ces études nous permettent d’envisager, à terme et une fois que ces mécanismes seront mieux compris, des périodes de rémissions fonctionnelles pour les personnes vivant avec le VIH, pourquoi pas après avoir «vidé» les réservoirs avec des multithérapies. La guérison, la vraie, pour toutes les personnes vivant avec le VIH, ne semble pas elle encore au programme.
Bibliographie
The first long-term remission of chronic HIV-1 infection without myeloablation?
Ricardo Diaz, UNIFESP, AIDS 2020.
In-depth characterization of full-length archived HIV genomes in long-term post-treatment and natural HIV controllers (ANRS CODEX/iVISCONTI Cohort)
Véronique Avettand-Fenoel (veronique.avettand@aphp.fr), Université Paris-Descartes, InsermInserm Institut national de la recherche médicale. CNRSCNRS Centre national de la recherche scientifique. Institut Cochin, Hôpital Necker-Enfants malades, AP-HPAP-HP Assistance publique-Hôpitaux de Paris. AIDS 2020
