Pénétration cutanée – une étape clé souvent aidée (abrasion/érosion locale ou vecteur)
Certains virus cutanés tels l’herpès simplex (HSV), le virus du molluscum contagiosum (MCV) et le virus de varicelle et du zona (VZV), ou le papillomavirus humains (HPV) ont un tropisme pour les kératinocytes, principales cellules de la couche superficielle de la peau (elles produisent la kératine qui rend la peau imperméable). D’autres comme le polyomavirus à cellules de Merkel (MCPyV) a tendance à se répliquer dans les fibroblastes dermiques et les lymphocytes T CD4+.
Les arbovirusArbovirose Les arboviroses sont des maladies virales dues à des arbovirus transmis obligatoirement par un vecteur arthropode (moustique, moucheron piqueur, tique) à des hôtes vertébrés (mammifères, oiseaux), d’où leur nom adapté de l’anglais : ARthropod-BOrne virus. du Nil occidental, de Zika, de la dengue et du chikungunya sont quant à eux introduits dans la peau par l’intermédiaire de moustiques vecteurs et provoquent une réponse inflammatoire locale avec implication de cellules immunitaires au site de l’infection cutanée, ce qui permet l’infection ultérieure des cellules immunitaires migratrices et une possible propagation systémique.
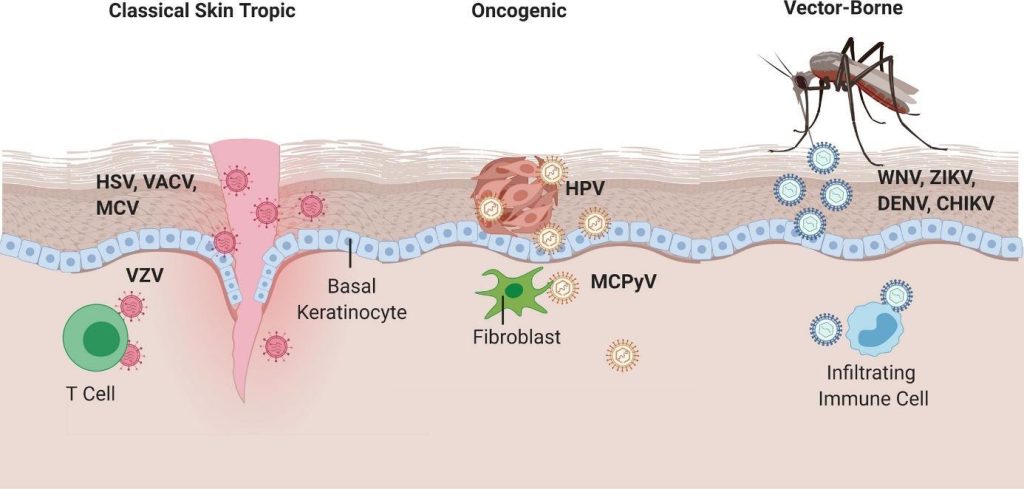
Source : Lei Vivian et al (2020) https://doi.org/10.3389/fimmu.2020.593901
La peau, un organe immunitaire primordial
La peau est une barrière physique et biologique et un organe immunitaire actif qui est le premier et le plus important site de défense contre l’environnement extérieur, et à l’instar d’autres voies de pénétration des microorganismes, les réponses immunitaires précoces déterminent souvent l’évolution et la gravité de l’infection.
A la frontière entre l’hôte et le monde extérieur, la peau surveille activement son environnement et établit une barrière et une réponse immunitaire adaptées au microbiote commensal, notamment aux bactéries, aux champignons et aux virus. Cependant, en cas de rupture de la barrière cutanée, la peau doit orchestrer des signaux immunitaires complexes pour se protéger contre l’infiltration et l’attaque d’envahisseurs pathogènes. Les réponses du système immunitaire inné cutané et de ses effecteurs jouent alors un rôle essentiel dans la destruction précoce des agents pathogènes ainsi que dans l’établissement d’une barrière immunitaire pour prévenir les infections systémiques. Cette action est assurée par les cellules phagocytaires (globules blancs polynucléaires, mastocytes, macrophages et cellules dendritiques), et les kératinocytes épidermiques. La pénétration d’agents étrangers active les récepteurs de reconnaissance de motifs moléculaires PRR (Pattern Recognition Receptors) de ces cellules immunitaires innées. Les PRR reconnaissent différents motifs moléculaires associés aux agents pathogènes (Pathogen-Associated Molecular Patterns ou PAMP) ou associés aux dommages (Damage-Associated Molecular Patterns ou DAMP) qui proviennent des cellules hôtes endommagées, ce qui conduit ensuite à l’induction de cytokines pro-inflammatoires, tels le facteur de nécrose tumorale (TNF-α) et l’interféron (IFN-γ), ainsi que de chimiokines qui recrutent les cellules phagocytaires. Les kératinocytes et les cellules immunitaires infiltrantes luttent aussi contre les agents pathogènes en générant des facteurs et des protéines aux propriétés antivirales.
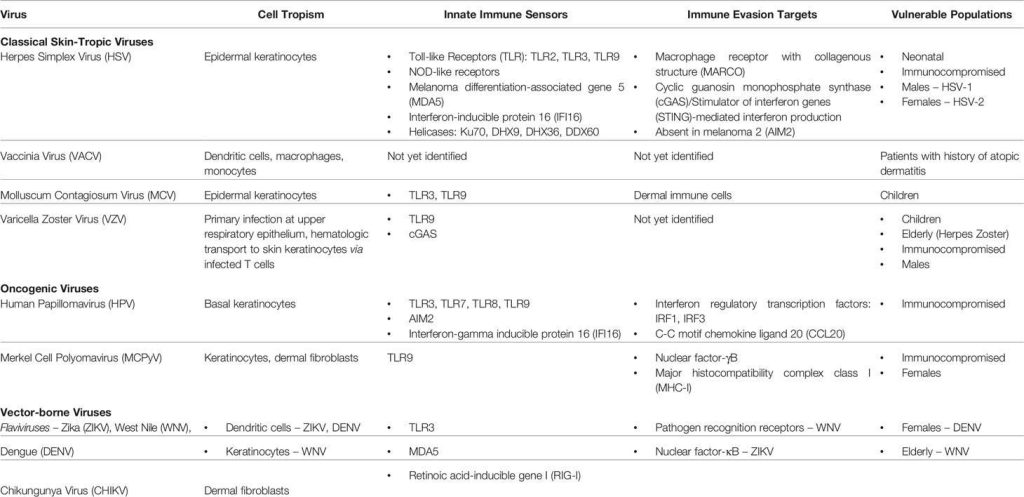
Source : Lei Vivian et al (2020) https://doi.org/10.3389/fimmu.2020.593901
La réaction cutanée initiale aux virus cutanés
L’infection virale cutanée représente un défi unique pour le système immunitaire cutané, car les virus ont la capacité de détourner la machinerie de l’hôte pour favoriser leur réplication. Ainsi, l’effet antiviral précoce par la réponse immunitaire innée limite le potentiel de propagation systémique. Celle-ci est cependant modulée par nombre de facteurs liés à l’hôte et à l’environnement, tels que l’âge de l’hôte, le sexe biologique et le microbiome commensal (voir figure ci-après).
A titre d’exemple les polymorphismes génétiques responsables de la dermatite atopique, du déficit en dédicateur de la cytokinèse 8 (DOCK8), du déficit en cellules NK (Natural Killer) et du déficit en tyrosine kinase 2 (TYK2) conduisent à une protection virale insuffisante. Les protéines antivirales, telles les OAS (oligoadenylate synthetases), Mx (myxovirus resistance), et IFITM (interferon-induced transmembrane) et celles des gènes stimulés par l’interféron (ISG), font partie de la réponse antivirale innée. Ces protéines exercent leurs propriétés antivirales en inhibant diverses étapes du cycle de réplication virale. Des facteurs tels que l’âge, le sexe biologique et le microbiome cutané peuvent potentiellement freiner ou renforcer les réponses antivirales innées. Les interactions microbiennes (bactéries-virus, virus-virus et champignons-virus), peuvent éventuellement avoir des effets antiviraux ou moduler les réponses antivirales de l’hôte. Une étude récente semble aussi indiquer que l’ascendance génétique pourrait intervenir (cf ci-après).
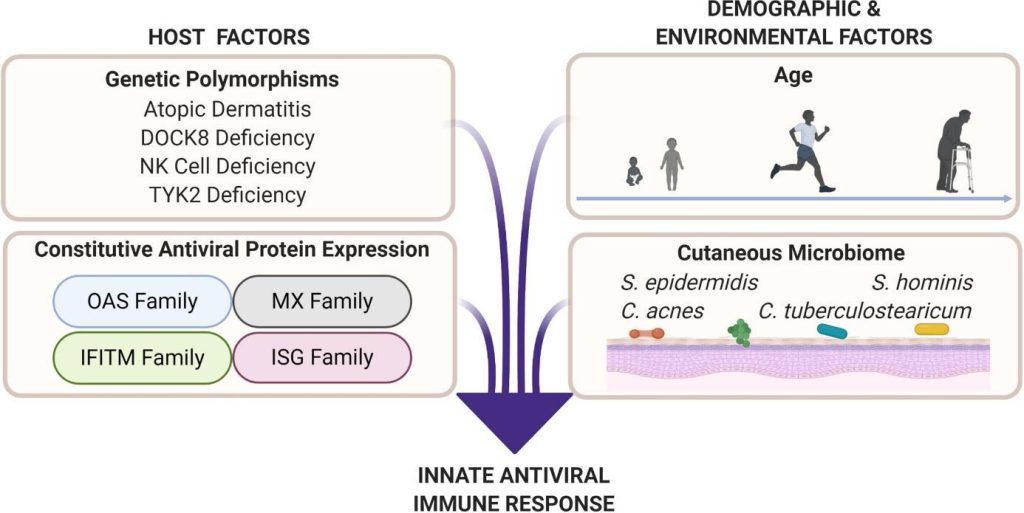
Source : Lei Vivian et al (2020) https://doi.org/10.3389/fimmu.2020.593901
La protection antivirale de la peau évolue avec l’âge. Les infections virales systémiques sont plus fréquentes chez les jeunes et les personnes âgées, où des facteurs tels que l’épaisseur de l’épiderme et l’immunité innée cutanée diffèrent sensiblement de ceux de la peau adulte saine. Une peau fine augmente la sensibilité aux micro-blessures et aux abrasions, offrant ainsi des voies d’entrée directes au virus. Une dérégulation de la signalisation immunitaire innée, conséquence de l’immaturité immunologique chez les jeunes ou de l’immunosénescence chez les personnes âgées, respectivement, accroît le risque d’infection virale systémique, car les défenses immunitaires ne parviennent pas à contrôler efficacement la propagation virale précoce. Les jeunes et les personnes âgées présentent également un risque accru d’exposition aux agents pathogènes viraux en raison de l’altération de l’intégrité de la barrière cutanée, qui peut se manifester par une dermatite atopique chez les jeunes et des plaies chroniques non cicatrisantes chez les personnes âgées.

Source : Lei Vivian et al (2020) https://doi.org/10.3389/fimmu.2020.593901
Spécificités des virus à transmission vectorielle (arbovirus)
Les moustiques infectent chaque année des centaines de millions de personnes à travers le monde, transmettant des virus responsables de maladies graves parmi lesquels les flavivirus (Zika ZIKV, Nil occidental VNO, dengue DENV) et les alphavirus (chikungunya CHIKV), qui sont tous des virus à ARN enveloppé. Ces virus utilisent différents types de cellules cutanées comme porte d’entrée : les flavivirus ciblent principalement les cellules dendritiques et les kératinocytes, tandis que les alphavirus infectent surtout les fibroblastes. Leur entrée dans les cellules est facilitée par la liaison entre leur glycoprotéine d’enveloppe et des récepteurs à la surface cellulaire (glycosaminoglycanes par ex.) ou plus spécifiques (par ex. les récepteurs des lectines de type C, intégrines αvβ3, TIM) et par l’endocytose dépendante de la clathrine.
Une fois dans la peau, ces virus déclenchent une réponse immunitaire innée via des PRR comme RIG-I, TLR3 et MDA-5 ce qui entraîne la production de cytokines et de protéines antivirales comme les OAS, Mx et ISG. Pour le ZIKV, une voie immunitaire indépendante de l’interféron récemment identifiée est médiée par l’IL-27 qui induit une réponse antivirale dans les kératinocytes, réduisant ainsi la pathogénicité lorsque le virus est introduit par voie cutanée. Cette découverte ouvre la voie à de nouvelles stratégies thérapeutiques ciblant les premières étapes de l’infection, avant la dissémination systémique.
Cependant, les arbovirus exploitent souvent les cellules immunitaires pour se propager. Une seconde vague d’infection suit l’arrivée de monocytes et de cellules dendritiques au site de piqûre, qui, une fois infectés, migrent vers les ganglions lymphatiques et facilitent la dissémination du virus. Des études ont montré qu’en inhibant certaines cytokines comme l’IL-1β, il est possible de réduire fortement l’infection des cellules immunitaires. Ces résultats soulignent que, contrairement à d’autres infections, le recrutement de cellules immunitaires dans le derme pourrait favoriser la propagation virale plutôt que sa neutralisation.
Enfin, la salive de moustique elle-même joue un rôle clé dans l’aggravation de l’infection. Elle modifie la réponse immunitaire locale en inhibant certains récepteurs et protéines antivirales, favorisant une réponse Th2 moins efficace. Par exemple, la salive peut inhiber la signalisation NF-κB ou réduire l’expression de PRR dans les cellules infectées. Cela renforce l’idée que l’environnement cutané immédiat après une piqûre constitue une fenêtre critique pour contenir l’infection. Étudier ces interactions spécifiques pourrait permettre de développer des traitements ou des vaccins ciblant cette phase précoce, avant la dissémination systémique des virus.
L’infection cutanée dans le cas de la dengue
La peau est le principal site de réplication du virus de la dengue (DENV) après inoculation par un moustique femelle infecté. Une infection virale productive de plusieurs populations de cellules cutanées résidentes a été documentée, notamment les kératinocytes et les cellules de Langerhans de l’épiderme, ainsi que les cellules dendritiques (CD), les macrophages, les fibroblastes et les cellules endothéliales du derme. La réplication virale est initiée dans les kératinocytes qui produisent des cytokines et des chimiokines inflammatoires, favorisant l’infiltration et l’infection locales des cellules myéloïdes résidentes de la peau, tandis que le recrutement de cellules NK par les mastocytes limite l’infection. L’inflammation et l’œdème en réponse aux piqûres de moustiques favorisent la réplication et la dissémination virales via les cellules myéloïdes recrutées et résidentes. On ignore actuellement dans quelle mesure l’ascendance génétique influence la réponse immunitaire cutanée au DENV et à d’autres infections à transmission vectorielle, ainsi que son impact sur la propagation systémique du virus et la maladie.
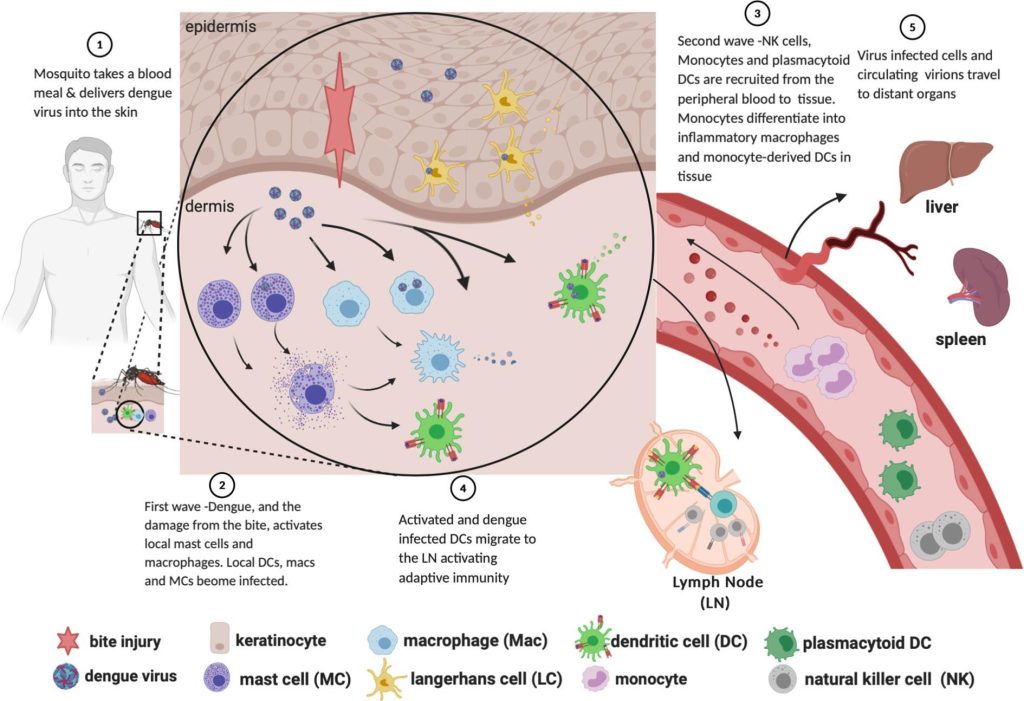
Réaction immunitaire cutanée au virus de la dengue
Source : King Christine A. (2020) https://doi.org/10.3389/fcimb.2020.574417
Dengue, peau et ascendance génétique
La dengue est une maladie virale transmise par les moustiques (arbovirose) très répandue chez l’homme, avec près de 8 millions de cas confirmés en 2024 dans le monde selon l’OMS, et une grande partie de la population potentiellement à risque. L’infection par l’un des quatre sérotypes du virus de la dengue (DENV) est le plus souvent spontanément résolutive, mais un nombre significatif de personnes présentent une dengue sévère caractérisée par une fuite plasmatique/syndrome de choc potentiellement mortels. Sur la base de données épidémiologiques sud- ou central-américaines, l’ascendance africaine est considérée comme partiellement protectrice contre la dengue sévère, mais les mécanismes en sont mal connus.
À l’aide de prélèvements cutanés provenant de donneurs génétiquement définis, une équipe vient de montrer que les échantillons de peau d’ascendance européenne présenteraient une réponse inflammatoire au DENV beaucoup plus forte que celle des échantillons d’ascendance africaine, provoquant une infiltration, une infection et une migration nettement accrues des cellules de Langerhans résidentes, des macrophages et des cellules dendritiques. Cet effet a été observé avec tous les sérotypes de DENV et de ZIKV, ainsi qu’en présence d’un sérum immun hétérotypique.
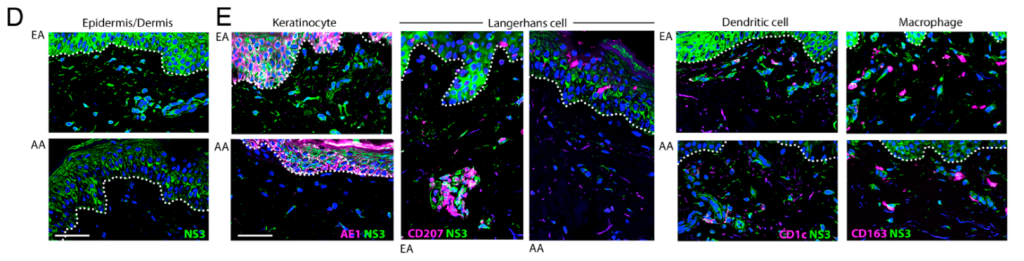
Images représentatives de l’immunofluorescence de sections cutanées d’individus d’ascendance européenne (EA) et d’ascendance africaine (AA) 24 h après l’inoculation du virus DENV-2, colorées avec des anticorps dirigés contre la protéine NS3 virale (D) et les marqueurs cellulaires indiqués (E). Les lignes pointillées délimitent la jonction épidermique-dermique. (Barre d’échelle : 100 µm.) La coloration bleue représente les noyaux cellulaires, la coloration verte représente la protéine NS3 virale et la coloration magenta représente les marqueurs cellulaires spécifiques notés. Source : Castanha Priscilla M.S., et al. (2025)
Les voies génétiques associées à l’inflammation, à l’interféron (IFN)-α et à la signalisation des cytokines inflammatoires étaient sensiblement plus fortes après l’infection dans les échantillons de peau d’ascendance européenne par rapport à ceux d’ascendance africaine. L’infiltration et l’infection des macrophages dans les échantillons de peau d’ascendance africaine ont augmenté par rapport à ceux de peau d’ascendance européenne après blocage de l’IFN-α et apport d’interleukine-1β.
Des variants polymorphes des gènes RXRA, OAS1-3 et TGFB1, plus fréquents chez les donneurs européens, ont été associés à une réplication virale accrue.
Ainsi, la réponse inflammatoire limitée de la peau d’ascendance africaine à l’infection semblerait limiter la réplication et la propagation de la dengue et potentiellement d’autres flavivirus. Les auteurs suggèrent que l’ascendance génétique devrait être prise en compte pour étudier la probabilité de survenue de dengue sévère chez les sujets/patients et pour évaluer l’efficacité et les effets indésirables des vaccins contre la dengue.
Quelques références
- Lei Vivian et al. Skin Viral Infections: Host Antiviral Innate Immunity and Viral Immune Evasion. Front Immunol. (2020),11:593901. https://doi.org/10.3389/fimmu.2020.593901.
- Castanha Priscilla M.S., et al. Genetic ancestry shapes dengue virus infection in human skin explants, Proc. Natl. Acad. Sci. U.S.A. (2025), 122 (28) e2502793122, https://doi.org/10.1073/pnas.2502793122.
- King Christine A. et al. Mobilization and Activation of the Innate Immune Response to Dengue Virus, Frontiers in Cellular and Infection Microbiology (2020), 10: 574417. https://doi.org/10.3389/fcimb.2020.574417.
- OMS – Global Dengue surveillance https://worldhealthorg.shinyapps.io/dengue_global/
