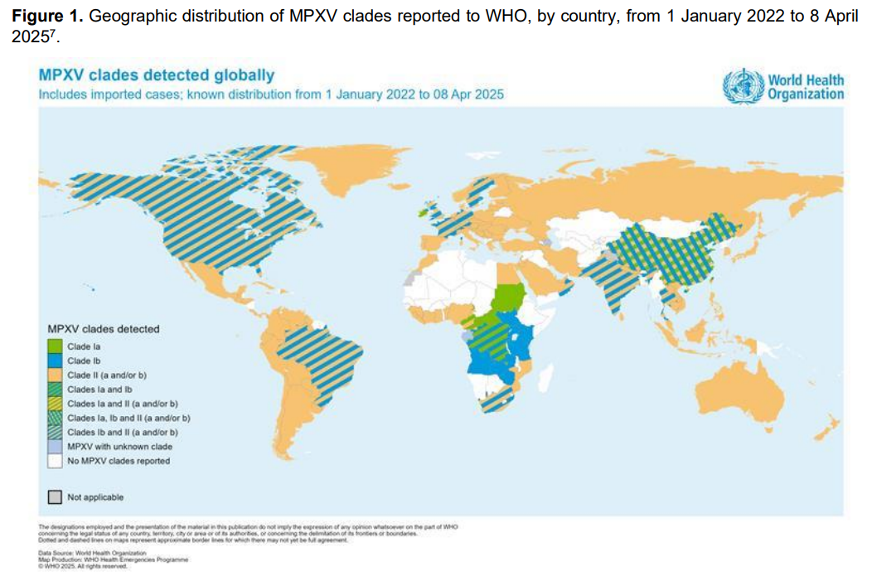
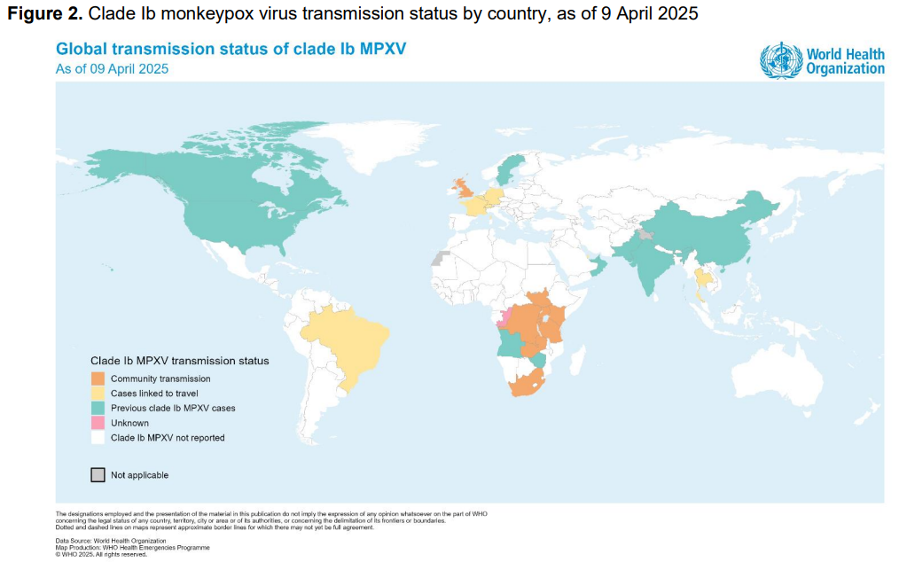
Le mpox est une maladie apparentée à la variole, causée par un virus qui fait aussi partie du groupe des orthopoxvirusOrthopoxvirus Famille de virus à laquelle appartiennent la variole, la vaccine et le monkeypox (mpox). La maladie qui affecte de manière générale principalement les singes et les rongeurs est une zoonose émergente. Des flambées épidémiques localisées ont régulièrement eu lieu jusqu’à ces dernières années en Afrique Centrale et de l’Ouest. Ces émergences ont été étudiées et surveillées jusqu’à l’émergence mondiale de la maladie, qui a conduit l’OMS à la déclarer urgence de santé publique de portée internationale (Public Health Emergency of International Concern) en mai 2022 suite à sa propagation «extraordinaire» dans plus de 75 pays non endémiques. Alerte levée en mai 2023, puis déclarée à nouveau en août 2024 (et maintenue depuis), devant la recrudescence du mpox en République démocratique du Congo et dans plusieurs pays voisins, ainsi que l’apparition d’une nouvelle souche virale possiblement plus transmissible ou pathogène, bien que cela ne soit pas établi (clade Ib). (lire notre article).
Le mpox se transmet à l’humain à partir des rongeurs (par exemple, en Afrique, des écureuils de forêt ou des cricétomes, gros rongeurs de la Savane connus sous les noms impropres de rats de Gambie ou rats géants). Toutefois, le réservoir animal n’a pas encore été formellement identifié. Il a été démontré que la transmission interhumaine soutenue laissait une signature distincte dans les génomes du mpox sous la forme de mutations induites par APOBEC3, fournissant un outil puissant pour déterminer dans quelle mesure, et depuis quand, le mpox a évolué chez l’homme. S’appuyant sur ces deux piliers, les données récentes de surveillance génomique de la République démocratique du Congo (RDC) et de la République du Congo ont clairement montré que la diversité du mpox reflétait principalement de nombreuses propagations zoonotiques indépendantes. Les données épidémiologiques de la RDC suggèrent que la fréquence de ces propagations a augmenté de 2010 à 2024, une période pendant laquelle le système national de surveillance a été relativement stable. D’après une étude publiée en 2021, concernant la République Centrafricaine, l’histoire génomique du mpox suggère aussi de multiples introductions depuis des réservoirs animaux forestiers avoisinants.
Une récente étude de Fabian Leendertz et al. non encore publiée – en cours de peer-review par Nature – apporte une réponse potentielle, en s’intéressant à une épizootieEpizootie Épidémie qui frappe les animaux. de mpox au sein d’une colonie de singes mangabeys fuligineux (Cercocebus atys) et mentionne un réservoir potentiel – un rongeur arboricole (écureuil) africain, le funisciure à pattes rousses (Funisciurus pyrropus).
Circulation du mpox chez des primates sauvages dans le parc national de Taï en Côte d’Ivoire
Le suivi sanitaire à long terme dans le cadre du Projet chimpanzés de Taï (TCP), dans le parc national de Taï (PNT), en Côte d’Ivoire, a permis de révéler que le mpox affecte également les primates non humains (PNH) sauvages, ouvrant ainsi une fenêtre sur l’écologie du virus et son cycle sylvatique. Ainsi, le mpox a été identifié chez un mangabey mort en 2012, puis au sein de trois épizootiesEpizootie Épidémie qui frappe les animaux. en 2017 et 2018 qui ont touché des groupes distincts de chimpanzés d’Afrique de l’Ouest (Pan troglodytes verus) vivant dans la même forêt. Bien que ces investigations ont permis de mieux comprendre les différentes présentations cliniques et de décrire la diversité génomique virale dans cette région, les origines de ces épizooties restent inconnues.
Une épizootie dans un groupe de mangabeys fuligineux sauvages début 2023
En trois mois, 30% des individus ont présenté des lésions cutanées et quatre nourrissons sont décédés. Le 27 janvier 2023, un nourrisson mangabey a développé des lésions maculaires rouges sur le front, l’arrière de la tête, le thorax et les jambes, accompagnées d’un début de léthargie et d’anorexie. Les lésions se sont rapidement propagées à l’ensemble du corps et l’individu est décédé dans les 48 heures, le 29 janvier. Début mars, cinq autres nourrissons ont développé des lésions similaires, accompagnées de léthargie, d’anorexie et d’adénopathies (augmentation de la taille des ganglions lymphatiques). Les lésions cutanées maculaires ont évolué vers des stades papulo-pustuleux, et trois de ces nourrissons sont décédés.
Une forme plus légère de la maladie, consistant soit en une éruption cutanée diffuse avec seulement environ 5 à 20 lésions cutanées, soit en un nombre plus restreint de lésions isolées apparaissant sur une seule partie du corps (par exemple, le visage, les membres ou la queue), a touché 20 autres mangabeys de tous âges. Chez tous les animaux atteints, les lésions papulo-pustuleuses ont évolué vers des vésicules, puis des croûtes. Globalement, la maladie a sévi dans le groupe jusqu’à la fin du mois d’avril 2023, entraînant le développement d’au moins une lésion cutanée visible chez 26 des 80 mangabeys (32,5%) et le décès de quatre d’entre eux. Des vétérinaires qualifiés, portant un équipement complet de protection individuelle et respectant des protocoles de biosécurité stricts, ont pratiqué des autopsies sur place sur trois des quatre nourrissons. Le corps du quatrième nourrisson n‘a jamais été retrouvé.
Investigation virologique concluant à l’imputabilité au mpox
Pour confirmer l’infection par le mpox, l’équipe scientifique a d’abord analysé des échantillons prélevés lors de l’autopsie des trois nourrissons et identifié l’ADN viral du mpox dans tous les principaux organes. Ils ont ensuite mené une enquête épidémiologique à l’échelle du groupe de mangabeys en analysant 170 échantillons fécaux prélevés pendant la période épizootique, définie comme la période où les signes cliniques étaient visibles dans le groupe. L’ADN du mpox a été détecté dans 36 échantillons fécaux prélevés sur 19 individus (7 symptomatiques et 12 asymptomatiques). Parmi ces 19 individus, 14 étaient des mères de bébés symptomatiques, et seulement six d’entre elles ont développé des lésions. Aucun mpox n’a été détecté dans 89 échantillons fécaux prélevés après la disparition des signes cliniques. Ces résultats montrent que le mpox a provoqué la maladie chez une grande partie de ce groupe et pourrait avoir infecté un groupe encore plus important d’individus de manière subclinique, ce qui concorde avec des observations antérieures chez les chimpanzés du TNP.
L’équipe a pu par la suite reconstituer deux génomes complets, à partir d’un échantillon autopsique prélevé le 31 janvier 2023 et d’un échantillon de selles prélevé le 12 février 2023. Les deux génomes étaient identiques et les analyses phylogénétiques les ont placés au sein de la cladeClade Les clades désignent les variations d’un même virus qui ont divergé au gré des mutations génétiques. IIa, comme proches parents des autres mpox du TNP. Cela suggère que cette épizootie serait le résultat d’un événement de transmission impliquant le(s) même(s) réservoir(s) local(aux), une même origine animale.
Identifier la source animale de l’épizootie de mpox : un écureuil d’Afrique ?
Plusieurs espèces d’écureuils (Funisciurus spp., Heliosciurus spp.) et d’autres rongeurs, tels que les cricétomes (Cricetomys gambianus) et les loirs africains (Graphiurus spp.), sont soupçonnés dans le cycle sylvatique du mpox. Afin de déterminer si des écureuils ou d’autres petits mammifères terrestres pourraient être une source d’infection par le mpox chez les primates non humains du PNT, l’équipe a testé des rongeurs et des musaraignes piégés (n = 694) ou trouvés morts (n = 10) à l’intérieur et autour du PNT entre 2019 et 2024.
Elle a ainsi identifié un funisciure à pattes rousses (Funisciurus pyrropus) positif au mpox, retrouvé mort le 3 novembre 2022, soit 12 semaines avant le début de l’épizootie chez les mangabeys, et à environ 3 km au sud de leur territoire. En raison du caractère opportuniste de l’échantillonnage, l’équipe n’a pas pu déterminer si l’écureuil en question était mort d’une infection par le mpox ou d’autres causes. Tous les organes de l’écureuil (n = 15), ainsi que les écouvillons buccaux et nasaux, contenaient des charges virales élevées, et l’équipe a pu isoler des mpox viables à partir de la peau, des poumons, de la rate et du foie de l’animal. Le génome complet de ce virus a été séquencé et il était identique aux génomes du mpox dérivés des échantillons de mangabeys. Depuis l’isolement du mpox chez des funisciures apparentés, les écureuils de Thomas (Funisciurus anerythrus) en 1978, peu de données ont étayé l’hypothèse selon laquelle des écureuils africains seraient des hôtes naturels du mpox. Les résultats de l’équipe de Fabian Leendertz et al. renforcent considérablement cette hypothèse. En effet, le même variant génomique du mpox circulait dans la population locale d’écureuils au cours des semaines précédant l’épizootie chez les mangabeys, ce qui constitue un premier indice que les écureuils pourraient avoir servi d’espèce réservoir.

Le funisciure à pattes rousses
Le funisciure à pattes rousses est un écureuil arboricole (famille des sciuridés, ordre des rongeurs), présent en Afrique de l’Ouest et en Afrique centrale au sein de quatre aires de distribution principales selon l’Union internationale pour la conservation de la nature, ce qui correspond aux zones d’apparition des foyers de mpox humains.
Selon le CNRSCNRS Centre national de la recherche scientifique. le funisciure à pattes rousses est un rongeur de la forêt équatoriale gabonaise que l’on rencontre souvent au ras du sol, dans les forêts primaires et secondaires ou les vieilles plantations situées en lisière. Il mesure entre 37 et 44 cm de la tête à la queue et pèse 300 grammes en moyenne. Son régime alimentaire est varié : insectes, racines, tubercules (manioc amer), graines de Staudtia gabonensis, etc.
Écureuil et comportement alimentaire des mangabeys – surveillance vidéo et analyse de selles
Les mangabeys sont connus pour chasser les petits mammifères, y compris dans le parc PNT. En examinant les données comportementales à long terme disponibles, l’équipe a trouvé un enregistrement vidéo de 2025 montrant un mangabey attrapant un écureuil, ainsi qu’une vidéo plus ancienne montrant un mangabey se nourrissant d’un funisciure à pattes rousses clairement identifiable. Afin de déterminer si la prédation d’un funisciure à pattes rousses pourrait être à l’origine de cette épizootie, l’équipe a analysé le régime alimentaire des mangabeys avant l’épizootie en recherchant l’ADN de ces proies dans les 78 premiers échantillons fécaux de leur collection. Elle a identifié des séquences d’ADN correspondant au génome mitochondrial du funisciure à pattes rousses du PNT dans deux échantillons fécaux. Ceci montre que les membres du groupe se sont nourris de cette espèce à au moins deux reprises au cours des semaines précédant l’épizootie. Plus frappant encore, l’un des deux échantillons contenant de l’ADN d’écureuil était également le premier échantillon fécal positif au mpox du cas index suspecté. La co-détection d’ADN d’écureuil et de mpox dans cet échantillon suggère fortement un cas exceptionnel de détection en temps réel d’un événement de transmission interspécifique, qui a ensuite conduit à l’épizootie de mpox à l’échelle du groupe. Sur la base de toutes les preuves accumulées, l’équipe avance donc que les funisciures à pattes rousses servent de réservoir de mpox pour les primates sauvages non humains du PNT.
Historique plausible de l’émergence du mpox au sein du groupe de mangabeys
L’équipe a ensuite cherché à affiner un scénario plausible d’émergence du mpox. Pour cela, elle a d’abord testé 114 échantillons fécaux prélevés dans le groupe des mangabeys au cours des 16 semaines précédant l’épizootie. Dix échantillons fécaux positifs au mpox ont ainsi été identifiés. L’ADN du mpox était présent dans les échantillons fécaux de sept mangabeys asymptomatiques au moment de la détection, dont la mère du premier nourrisson à présenter des signes cliniques. Il est important de noter que les trois premiers échantillons positifs ont été obtenus consécutivement chez le même individu, les 6, 9 et 18 décembre 2022. L’ensemble de ces résultats suggère que le mpox a été introduit dans le groupe par l’intermédiaire de ce cas index plausible, puis y a circulé sans être détecté pendant près de deux mois.
Rongeurs et viande de brousse
Dans de nombreuses régions d’Afrique subsaharienne, le déclin récent des grands mammifères dû à la destruction de leur habitat et à la chasse a entraîné une réorientation de la consommation vers les petits animaux, notamment les rongeurs. Si les primates restent couramment commercialisés et consommés, ainsi que des rongeurs de plus grande taille – les cricétomes improprement appelés rats géants ou rats de Gambie (Cricetomys spp.) et l’aulacode des marais ou «agouti» (Thryonomys swinderianus) – plusieurs espèces d’écureuils sont également vendues et consommées, tant en milieu rural qu’urbain.
Contrairement aux primates non humains qui dépendent principalement des écosystèmes forestiers intacts, les écureuils peuvent prospérer dans des habitats fragmentés et des plantations proches des villages. Après une nouvelle analyse d’un ensemble de données, l’équipe n’a détecté des funisciures à pattes rousses que dans les forêts secondaires et les plantations, ce qui suggère une présence plus élevée de cette espèce dans ces habitats : les écureuils y sont fréquemment piégés par la population locale, y compris les enfants, et consommés directement. La chasse, le commerce et la consommation de viande de brousse peuvent entraîner une transmission du mpox à l’homme.
La source de cette épizootie certes, mais un réservoir potentiel ?
Pour établir les funisciures à pattes rousses comme réservoirs du mpox, des recherches sont encore nécessaires sur l’écologie, l’utilisation de l’habitat et la dynamique de ces populations de rongeurs arboricoles, ainsi que sur la dynamique des infections par le mpox dans ces populations et leurs interactions avec l’homme, pour évaluer les risques de propagation du mpox à partir de cette espèce. De même, l’existence d’un réservoir animal repose généralement sur le fait que l’infection de l’espèce réservoir soit asymptomatique ou paucisymptomatique.
Les efforts visant à identifier d’autres espèces de petits mammifères susceptibles de servir d’hôtes et de réservoirs naturels doivent également être poursuivis, car l’implication de plusieurs espèces hôtes est possible. Parallèlement, la surveillance génomique du mpox chez l’homme dans les zones d’endémie reste la source d’information la plus abondante sur la diversité de ce virus dans son ou ses réservoirs. Par exemple, l’équipe scientifique a observé que les génomes publiés à partir de cas humains de mpox causés par la clade IIa en Côte d’Ivoire en 2024, dont deux provenant d’une ville située à environ 80 km au nord du site d’étude, n’étaient pas étroitement liés à ceux circulant dans la faune du PNT. Ce qui suggère une grande diversité de souches, même à une petite échelle spatiale, et une structure géographique et une évolution chez des hôtes distincts, bien que des études complémentaires soient nécessaires pour vérifier cette hypothèse de manière concluante.
Une meilleure compréhension de l’écologie du mpox éclairera les autorités locales en charge de la santé publique, de la santé animale, ainsi que des aires protégées et des ressources naturelles, et les aidera à développer des programmes de gestion des risques de propagation. Cela pourrait inclure des campagnes de sensibilisation aux risques généraux liés à la viande de brousse et des initiatives de co-conception de mesures visant spécifiquement à réduire les contacts avec les écureuils par la chasse de subsistance. L’exemple du PNT montre (1) le lien direct entre un réservoir de rongeurs et un hôte de propagation et (2) que les deux peuvent être des sources d’infections humaines, ce qui suggère qu’il serait erroné de se concentrer uniquement sur la consommation d’écureuils.
Quelques références :
Leendertz F., Riutord-Fe C., Schlotterbeck J. et al. Fire-footed rope squirrels (Funisciurus pyrropus) are a reservoir host of monkeypox virus (Orthopoxvirus monkeypox), 08 April 2025, PREPRINT (Version 1) available at Research Square [https://doi.org/10.21203/rs.3.rs-6322223/v1] https://www.researchsquare.com/article/rs-6322223/v1
Le site de l’institut Pasteur: https://www.pasteur.fr/fr/centre-medical/fiches-maladies/mpox-anciennement-variole-du-singe
Berthet, N., Descorps-Declère, S., Besombes, C. et al. Genomic history of human monkey pox infections in the Central African Republic between 2001 and 2018. Sci Rep 11, 13085 (2021). https://doi.org/10.1038/s41598-021-92315-8
Des facteurs d’émergence bien connus:
– Transports et voies de communications (vols internationaux, …),
– Déforestation et changement de destination des terres, pénétration dans des zones sauvages,
– Agriculture et élevage intensifs,
– Changement climatique,
– Les migrations de populations/précarisation – exode rural vers les grandes villes,
– Trafic illégal et consommation de faune sauvage,
– Résistance aux antimicrobiens.