L’approche One Health, fondée sur l’interdépendance entre la santé humaine, animale et environnementale, s’impose aujourd’hui comme une nécessité face aux défis sanitaires contemporains. Loin d’être un simple mot d’ordre, cette vision intégrée remet en cause notre manière de concevoir les priorités en matière de santé publique. Si cette approche est de plus en plus utilisée dans le contexte de l’augmentation des maladies infectieuses émergentes, son utilisation dans le cadre spécifique de la vaccination reste peu importante malgré sa pertinence évidente.
Socle historique et conceptuel du One Health
Le concept de One Health est ancien. Déjà au XIXe siècle, Rudolf Virchow posait les bases d’une vision unifiée de la santé. Plus tard, William Osler évoquait la “One Medicine”, préfigurant l’idée que les pathologies humaines et animales partagent de nombreux mécanismes. Cette convergence des santés a été formalisée plus récemment par les grandes organisations internationales, à commencer par la FAO (l’Organisation des Nations unies pour l’alimentation et l’agriculture), l’OIE (Office international des épizootiesEpizootie Épidémie qui frappe les animaux. aujourd’hui Organisation mondiale de la Santé animale) et l’OMS (Organisation mondiale de la Santé) qui définissent ainsi ce concept : «Le principe “Une seule santé” consiste en une approche intégrée et unificatrice qui vise à équilibrer et à optimiser durablement la santé des personnes, des animaux et des écosystèmes. Il reconnaît que la santé des humains, des animaux domestiques et sauvages, des plantes et de l’environnement en général (y compris des écosystèmes) est étroitement liée et interdépendante. L’approche mobilise de multiples secteurs, disciplines et communautés à différents niveaux de la société pour travailler ensemble à fomenter le bien-être et à lutter contre les menaces pour la santé et les écosystèmes. Il s’agit également de répondre au besoin collectif en eau potable, en énergie propre, en air pur, et en aliments sûrs et nutritifs, de prendre des mesures contre le changement climatique et de contribuer au développement durable.»
De nombreux facteurs dont des facteurs environnementaux comme la localisation géographique – dans laquelle intervient également la composition du microbiome – influencent la réponse vaccinale donnant en soi une dimension One Health à la vaccination (1). Toutefois, la vaccination One Health envisage essentiellement l’impact sur la transmission des pathogènes ou des maladies alors que des bénéfices beaucoup plus larges peuvent résulter de la prise en considération de ces dimensions multiples.
Les maladies humaines sont souvent le résultat de contacts directs ou indirects avec des animaux ou des éléments environnementaux contaminés. Le contrôle de la pandémie de covid-19Covid-19 Une maladie à coronavirus, parfois désignée covid (d'après l'acronyme anglais de coronavirus disease) est une maladie causée par un coronavirus (CoV). L'expression peut faire référence aux maladies suivantes : le syndrome respiratoire aigu sévère (SRAS) causé par le virus SARS-CoV, le syndrome respiratoire du Moyen-Orient (MERS) causé par le virus MERS-CoV, la maladie à coronavirus 2019 (Covid-19) causée par le virus SARS-CoV-2. a nécessité une approche intégrée incluant la surveillance et la gestion de la faune et de l’environnement en parallèle des efforts pour limiter la transmission humaine. Les animaux sont des réservoirs potentiels de nombreuses infections, et certaines de ces maladies peuvent être transmises aux humains. Une bonne gestion de la santé animale, notamment par la vaccination et la surveillance épidémiologique, est donc essentielle pour limiter les risques pour l’homme. Les écosystèmes jouent un rôle crucial dans la propagation des maladies. Des environnements dégradés ou perturbés peuvent créer des conditions propices à l’émergence de nouvelles zoonoses. De plus, le changement climatique, la déforestation et la pollution influencent la transmission des pathogènes entre les animaux et les humains. Les maladies vectorielles comme le paludisme et la dengue, qui dépendent des conditions environnementales, illustrent bien cette dynamique. Les environnements naturels et modifiés par l’homme interagissent de manière complexe avec la santé des humains et des animaux, rendant les stratégies fragmentées inefficaces (2).
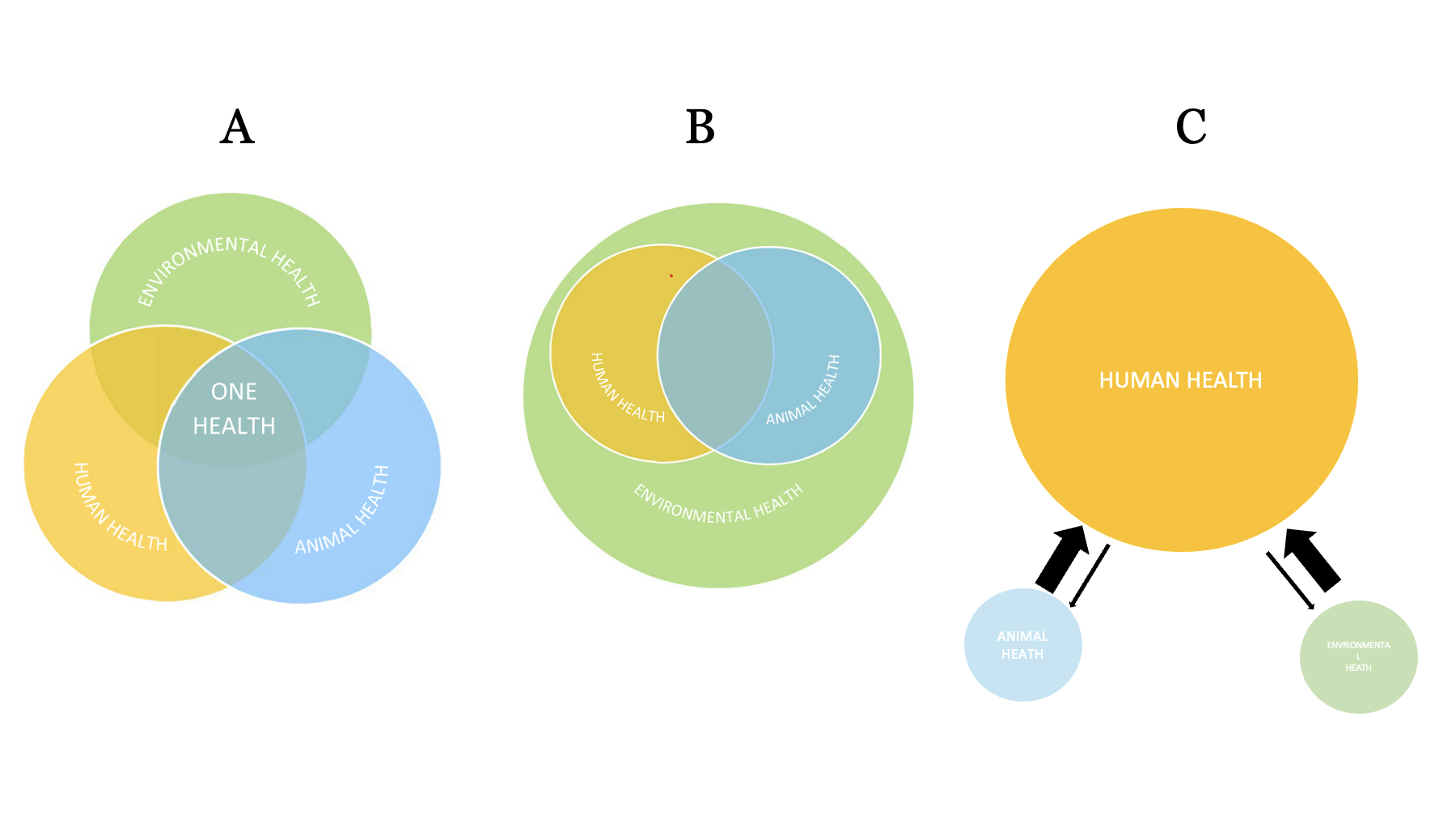
La représentation classique du « One Health » fait apparaître ce concept au croisement entre les trois santés (Figure 1 A). F Selter et S Salloch en ont proposé une vision différente, plus pertinente dans laquelle l’environnement englobe l’ensemble (3) (Figure 1B). Toutefois, à l’heure actuelle, ce concept reste aujourd’hui dominé par une vision centrée sur la santé humaine. L’étude de la biomasse terrestre montre la réalité de la part respective des êtres vivants : 450 gigatonnes de carbone pour les plantes, 70 pour les bactéries, et seulement 2 pour les animaux, dont une fraction minime est constituée d’humains (4). Cependant, si les représentations précédentes envisagent les santés humaine, animale et environnementale sur un pied d’égalité, force est de constater qu’actuellement les politiques One Health restent centrées sur les humains (Figure 1C).
Quelques spécificités de la vaccination vétérinaire
Afin d’envisager la vaccination One Health, il convient de préciser quelques spécificités de la vaccination vétérinaire. Celle-ci repose sur des objectifs propres (protéger la santé des animaux) mais également des objectifs «altruistes» puisqu’elle vise à garantir la sécurité alimentaire, à éviter les pertes économiques et à limiter la transmission de zoonoses, ces trois aspects visant à impacter directement la santé humaine.
Trois types d’animaux, avec des caractéristiques différentes, sont concernés par la vaccination vétérinaire : animaux de compagnie, animaux de rente, animaux sauvages. Il existe une grande disparité de répartition entre celles-ci. En effet, les mammifères sauvages ne représentent plus que 4% de la biomasse des mammifères, écrasés par les animaux d’élevage (63%) et les humains (34%) (5). Même si elle est moins déséquilibrée, la répartition entre faune sauvage et domestique est également en faveur de cette dernière pour les oiseaux (29% versus 71%). À noter la part également importante et croissante prise par les animaux de compagnie. Leur nombre à l’échelle de la planète atteindrait le milliard, selon l’étude Mars Global Pet Parent 2024, et ils seraient présents aux côtés de 48% des êtres humains (6). Il existe également une grande disparité de longévité entre les espèces sauvages (plus de 200 ans pour la baleine boréale, 40 ans pour les chimpanzés, jusqu’à 100 ans pour certains aras) et domestiques, notamment en ce qui concerne les animaux de rente : généralement très courte pour les animaux consommés pour leur viande (6 à 8 mois pour un porc, 3 mois pour un canard) et plus longue pour les animaux produisant des aliments consommés par l’homme (2 ans pour une poule pondeuse, 20 ans pour une vache laitière). La durée de vie des animaux a évidemment un impact sur les stratégies vaccinales mises en place (nombre d’injections initiales, rappels, etc.).
Les voies d’administration des vaccins sont les mêmes que chez l’homme avec toutefois quelques spécificités : injection in ovo, vaccination par aérosols, voire balnéothérapie chez les poissons (7). Si les plateformes vaccinales sont les mêmes pour les vaccins vétérinaires que pour les vaccins humains (vaccins inactivés, vecteurs viraux – souvent des poxvirus –, protéines recombinantes, et plus récemment ARN messagers), les vétérinaires préfèrent utiliser pour la vaccination des animaux de rente, des vaccins DIVA (Differentiating Infected from Vaccinated Animals) (8). Il s’agit de favoriser des vaccins qui ne reposent pas sur l’utilisation d’un pathogène entier (vaccin protéique, vecteurs viraux, ARNm ou ADN) permettant ainsi de distinguer le cas échéant les animaux vaccinés (réponses immunitaires contre seules protéines inclues dans le vaccin) des animaux infectés (réponses immunitaires contre toutes les protéines du pathogène), point crucial dans le suivi sanitaire des élevages.
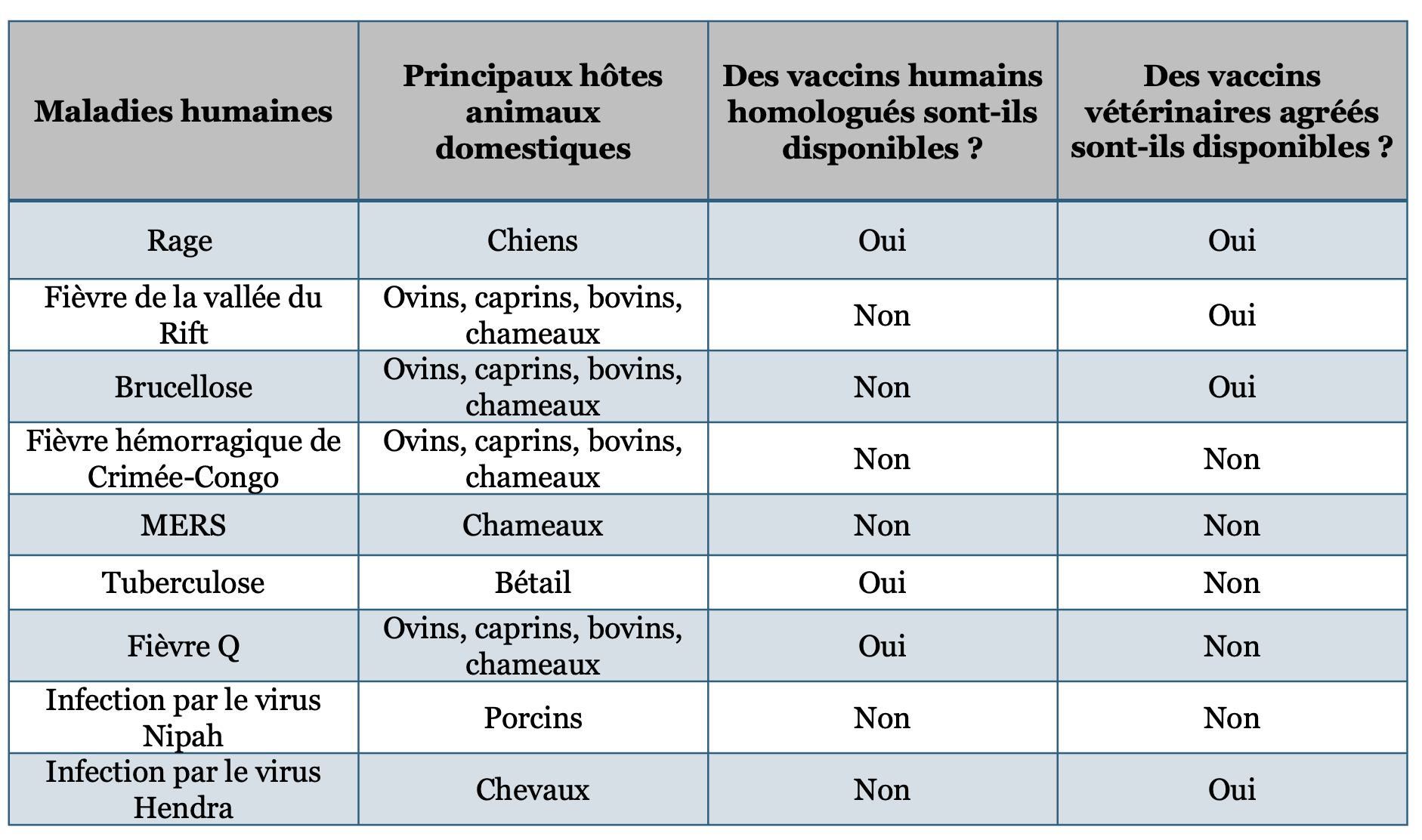
Le développement vaccinal est plus rapide et moins coûteux que chez l’homme. Là où un vaccin humain peut nécessiter 10 à 15 ans de développement et 1 milliard d’euros, un vaccin vétérinaire peut être prêt en trois ans pour environ 15 millions (9). Les vaccins vétérinaires sont également moins contraints par les exigences réglementaires, les questions de tolérance sont moins importantes que chez l’homme si l’efficacité est au rendez-vous. Au final, si le nombre de vaccins pour chaque espèce est inférieur à celui disponible pour l’homme, le nombre des vaccins vétérinaires est plus grand (Tableau 1).

La vaccination vétérinaire au service de la santé humaine
La vaccination vétérinaire peut avoir de multiples impacts sur la santé humaine agissant comme un outil de protection de la sécurité alimentaire et de l’économie agricole, de prévention des zoonoses, de lutte contre la résistance aux antimicrobiens, d’accélération de la compréhension de l’immunité contre les agents pathogènes, voire dans certains cas de prévention de maladies non transmissibles. Malgré leur complémentarité évidente, les vaccinations humaine et vétérinaire progressent souvent en parallèle et ne se retrouvent qu’en de très rares cas. Il est important toutefois de comprendre comment la vaccination vétérinaire peut impacter de manière importante la santé humaine.
Vaccination vétérinaire et sécurité alimentaire : l’exemple emblématique de la peste bovine
La peste bovine était une maladie virale infectant les bovins domestiques et sauvages, causée par morbillivirus pecoris, virus de la famille des Paramyxoviridae. Il existait des réservoirs ovin, caprin et porcin avec un portage asymptomatique. Chez les bovins, la présence de souches hypervirulentes était à l’origine d’infections associées à une mortalité proche de 100%. Cette pathologie a été à l’origine de la création de la première école vétérinaire mondiale à Lyon en 1762 par Claude Bourgelat. Félix Vicq d’Azyr, médecin à l’origine de la création de la Société royale de médecine, y consacra un ouvrage en 1774, montrant que la pertinence d’une approche One Health est ancienne.
Un premier vaccin a été mis au point en 1941 puis des campagnes de vaccination massive ont été lancées à partir des années 1960 sous l’égide de la FAO et de l’OIE. Le programme Global Rinderpest Eradication Programme (GREP) a permis d’éliminer progressivement la maladie, avec une déclaration officielle d’éradication en 2011, marquant la seconde éradication mondiale d’une maladie infectieuse après la variole humaine (10). L’éradication de la peste bovine a eu des répercussions majeures sur la sécurité alimentaire et économique dans les régions touchées. En stabilisant durablement la production de viande et de lait, elle a contribué à réduire la précarité des agriculteurs, souvent fortement dépendants de l’élevage pour leur subsistance. Ainsi, au-delà de la seule santé animale, la lutte contre la peste bovine a représenté un puissant levier de développement économique et de résilience pour les communautés rurales.
La grippe aviaire, sur laquelle nous reviendrons, en revanche, reste un problème mondial non résolu, avec des coûts colossaux liés à l’abattage massif de volailles et aux pertes économiques. En France, la vaccination des canards a permis de réduire significativement le nombre de foyers infectieux, mais l’exportation reste entravée par la réticence de certains pays vis-à-vis des produits animaux vaccinés.
Vaccination One Health et lutte contre les zoonoses
La lutte contre les zoonoses est l’objectif le plus évident de la vaccination One Health, le sort des animaux et des hommes étant ici clairement lié, la pandémie de covid-19 ayant fait apparaître aux yeux de tous l’importance des pathologies émergentes. Les zoonoses représentent 75% des maladies infectieuses émergentes, 60% des maladies infectieuses chez l’homme proviennent d’un réservoir animal ; enfin, chaque année à l’échelle de la planète, les zoonoses sont responsables de 2,5 milliards d’évènements cliniques à l’origine de 2,7 millions de décès (11). L’accroissement des relations entre l’homme et l’animal (pratiques d’élevage, croissance du marché des animaux de compagnie, changement climatique et perturbations des écosystèmes, développement anthropogénique des habitats, multiplication des voyages accroissement du commerce à l’échelle mondiale) explique l’augmentation de celles-ci.
On distingue quatre types d’anthropozoonoses selon qu’elles font intervenir uniquement un seul être vertébré (orthozoonoses), plus d’une espèce vertébrée mais pas d’hôte invertébré (cyclozoonoses), des vertébrés et des invertébrés (phérozoonoses), ou implique en plus un réservoir/site de développement inanimé (saprozoonoses) (12). La complexité de la lutte contre ces zoonoses sera évidemment d’autant plus grande, et la mise en place de stratégies combinées de vaccinations d’autant plus complexe que le nombre d’acteurs impliqués sera plus grand. Les transferts se font également de l’homme vers animal. Le nombre de ces zoonoses inverses est en augmentation constante, et implique tout type de pathogènes : des parasites avec, par exemple, la transmission de Giardia dudodenalis au Lycaon en Afrique (14) ; des virus avec la transmission des virus aviaires et humains au porc (15) ; des bactéries avec comme dans les cas de transmissions de la souche humaine Escherichia coli 025 :H4-ST131 CTX-M-15 (16).
Prévention des pandémies : la menace persistante des virus aviaires
La grippe représente l’archétype de l’anthropozoonose. Chez l’homme, elle évolue sous la forme de pandémies secondaires à l’irruption d’une nouvelle souche aviaire, puis sous la forme ensuite d’épidémies annuelles. On a décrit à l’époque moderne quatre pandémies de grippe, toutes liées à des virus influenza de type A : la grippe dite espagnole en 1918-1919 avec un virus H1N1, la grippe asiatique en 1957 avec un virus H2N2, la grippe de Hong Kong en 1968 avec un virus H3N2, la grippe russe de 1977 avec un virus H1N1. L’immunité contre la grippe est complexe, car elle est en partie façonnée par les souches virales rencontrées durant l’enfance. Cette première infection joue un rôle déterminant dans le développement de réponses immunitaires croisées qui se manifesteront lors de futures infections ou vaccinations.
Les oiseaux sauvages sont les réservoirs des virus de la grippe. Ils sont capables de transmettre le virus à un grand nombre de mammifères, dont l’homme. Nous sommes actuellement confrontés à un risque de pandémie liée à un virus de type H5N1 transmis par les oiseaux. Depuis 2003, plus de 900 cas de grippe A(H5N1) chez l’homme ont été signalés dans plus de vingt pays. Il s’est agi à chaque fois d’infections sporadiques avec exposition directe ou indirecte à des animaux infectés ou à des environnements contaminés. Si ces infections ont pu être graves, voire mortelles, aucun cas de transmission interhumaine durable n’a été rapportée. Un réassortiment entre le 2.3.4.4b H5N8 et les virus de l’influenza aviaire faiblement pathogène (IAFP) a généré le virus panzootique 2.3.4.4b H5N1 (Europe ou Asie centrale vers 2020), virus hautement pathogène (IAHP) qui est la source des inquiétudes actuelles. D’autres réassortiments ultérieurs ont donné naissance aux génotypes AB et BB21,32, B3.2 et B3.13 ayant notamment infecté des mammifères marins d’Amérique du Sud et des vaches laitières américaines (17, 18). L’homme et les porcs représentent des hôtes particuliers (mixing vessels) des virus de la grippe. En effet, ils expriment les acides sialiques α2,3 et α2,6 les rendant susceptibles aussi bien aux virus humains (α2,6) qu’aviaires (α2,3) et peuvent dès lors, favoriser des recombinaisons à l’origine de souches pandémiques.
On dispose de vaccins humain et vétérinaire et une approche vaccinale One Health pourrait dès lors logiquement être envisagée. Toutefois la protection induite par la vaccination chez l’animal reste, comme chez l’homme, imparfaite. Plusieurs risques liés à la vaccination antigrippale chez l’animal ont été identifiés (19) :
- Un risque de transmission à bas bruit de l’infection par les animaux vaccinés ceux-ci étant susceptible d’excréter le virus après infection malgré la vaccination (20) ;
- Un risque de pression de sélection antigénique (21) ;
- Un risque de faux sentiment de sécurité entraînant une sous-estimation de signes cliniques mettant en péril la détection immédiate de l’IAHP dans les élevages vaccinés (22) ;
- Enfin, un risque économique des restrictions internationales existant concernant la diffusion et la vente de produits à base de volailles vaccinées (23).
Quels sont les retours d’expériences des pays ayant mis en place une vaccination contre la grippe aviaire à large échelle dans les élevages de volaille ? Le premier exemple est celui de la vaccination contre le virus H7N9 en Chine (24). Ce virus, apparu en 2013, en tant que virus faiblement pathogène chez les poulets a évolué vers une forme hautement pathogène en 2017. De 2013 à 2017, on a recensé 1567 infections humaines, avec un taux de mortalité >30 %. Pour répondre à cette infection, un vaccin inactivé bivalent H5/H7 a été mis au point chez l’animal, 73% des élevages de poules pondeuses et de poulets de chair à croissance lente ont alors été vaccinés. L’efficacité a été remarquable chez la volaille (réduction de 93,3% de l’incidence chez les poulets) et chez l’homme (seuls trois cas humains de H7N9 ont été signalés depuis le 1er octobre 2017, date du début de la vaccination chez les animaux). Le virus a muté pour infecter les canards pour lesquels une large couverture est plus compliquée à mettre en place en Chine (24). Malgré cela, les données récentes n’indiquent pas de reprise d’expansion du virus parmi les animaux d’élevage (25).
Le deuxième est une étude comparative de la variabilité virale dans les pays où la vaccination antigrippale a été mise en place chez les volailles (Égypte et Indonésie) et ceux où elle ne l’a pas été (Nigeria, Turquie et Thaïlande). Elle a consisté en l’analyse de 751 séquences du cadre de lecture ouvert complet de l’hémagglutinine (segment de l’ADN susceptible d’être transcrit en ARN messager pour être traduit en protéine ou en peptide). Les taux d’évolution et le nombre de sites positivement sélectionnés étaient plus élevés dans les populations de virus circulant dans les pays où la vaccination a été mise en place, suggérant l’existence d’un pression de sélection induite par la vaccination (26).
La France a décidé en 2023 de développer une vaccination contre la grippe aviaire hautement pathogène H5N1 (27) en ciblant spécifiquement les canards, ceux-ci étant les acteurs majeurs dans l’épidémiologie de l’IAHP en France. En 2023-2024, plus de 60 millions de canards ont été vaccinés avec un vaccin inactivé ou un vaccin ARNm. Seuls 15 foyers d’infections ont été mis en évidence durant la même période contre 400 la saison précédente. Il s’agit d’un succès évident, même si l’impact sur la santé des hommes ne peut être évalué dans ce contexte.
Si l’approche One Health est envisagée par nombre d’experts dans le contexte de la grippe zoonotique, ceux-ci restent prudents sur la mise en place des stratégies vaccinales larges associant les différentes espèces (28). La vaccination humaine contre le H5N1 va sans doute devenir nécessaire. On dispose actuellement de 21 vaccins contre des souches H5N1 disponibles en médecine humaine. Un seul cependant a une H5 qui correspond à la souche zoonotique actuelle mais avec une nucléocapside N8. Un seul pays (la Finlande) a mis en place un programme de vaccination contre le virus A(H5) pour les groupes à risque (éleveurs de volailles et de visons, vétérinaires, autres personnes exposées) (29).
Vaccination One Health efficace avec des vaccins différents : l’exemple de la rage
La rage représente un exemple assez caractéristique d’une vaccination One Health potentiellement efficace quand elle peut être mise en place. La rage est une maladie infectieuse négligée à l’origine d’un fardeau de santé publique dans plus de 150 pays et territoires (Asie et en Afrique ++), associée à des dizaines de milliers de décès chaque année (40% d’entre eux survenant chez des enfants de moins de 15 ans) (30). Au cours des trois dernières décennies, la mise en œuvre de programmes de vaccination des renards avec un vaccin oral a permis d’éliminer la rage dans de vastes régions d’Europe occidentale et centrale (31) montrant la pertinence de l’approche One Health. Dans les pays où la maladie reste endémique, 99% des cas de rage humaine sont occasionnées par des griffures ou des morsures de chien. Malheureusement de nombreux pays (Thaïlande, Vietnam, Sri Lanka) privilégient encore une stratégie de vaccination post exposition chez l’homme. Si celle-ci est efficace, son coût est très élevé – 27 millions de dollars par an au Vietnam – très supérieur à celui d’une vaccination large des chiens a priori beaucoup plus rentable : les coûts par chien vacciné sont généralement estimés faibles, par exemple 1,3 dollars en Thaïlande (30). Le fait que les vaccinations de l’homme et des animaux soient souvent gérées par des structures différentes (ministère de la Santé vs ministère de l’Agriculture) n’aide pas à la mise en place, ici comme ailleurs, d’une approche holistique.
Vaccination One Health avec des vaccins identiques : l’exemple de la fièvre de la vallée du Rift
Des initiatives récentes explorent le développement de vaccins uniques One Health utilisable à la fois chez l’homme et l’animal. La fièvre de la vallée du Rift (FVR) est une zoonose virale causée par un phlébovirus transmis par des moustiques du genre Aedes et Culex. Endémique en Afrique subsaharienne, elle se manifeste par des épizooties chez les ruminants domestiques (bovins, ovins et caprins) avec, chez ces animaux, des taux élevés d’avortements et de mortalité néonatale. La majorité des cas humains sont bénins mais des formes graves peuvent survenir, incluant des cas d’hépatites et de méningo-encéphalites. Les infections du bétail ont un fort impact sanitaire, économique et social, en particulier dans les zones à forte densité d’élevage.
Plusieurs candidats vaccins ont été développés incluant des vaccins vivants atténués (VFVR clone 13, MP 12) ou inactivés (TSI-GSD-200) disponibles chez l’homme et l’animal mais avec des problèmes multiples : problèmes de tolérance, de difficultés de production, de non-différentiation infection/vaccination, et de risque de diffusion des souches vaccinales par les moustiques (VVA) (32). Parmi les nombreux autres candidats vaccins en cours de développement, le plus intéressant est celui reposant sur l’utilisation de la plateforme ChAdOX1 (désormais bien connue pour son utilisation pour un vaccin contre le Sars-CoV-2) exprimant les protéines Gn et Gc du virus. Ce vaccin, qui a pu montrer son efficacité dans la protection contre l’infection chez l’animal (mouton, bœuf, chèvre) (33), a été également testé dans un essai de phase 1 chez l’homme avec des résultats très satisfaisants en termes de tolérance et d’immunogénicité (34) ouvrant la perspective à un développement commun chez l’homme et l’animal. D’autres maladies pour lesquelles des programmes de vaccination inter-espèces sont envisageables ont été identifiées (35) (Tableau 2), certains envisageant même de cibler plusieurs virus ensemble, comme dans le cas du candidat vaccin contre le MERS basé sur l’utilisation d’un vecteur viral rabique (36).
Faune sauvage et vaccination : potentiel et limites
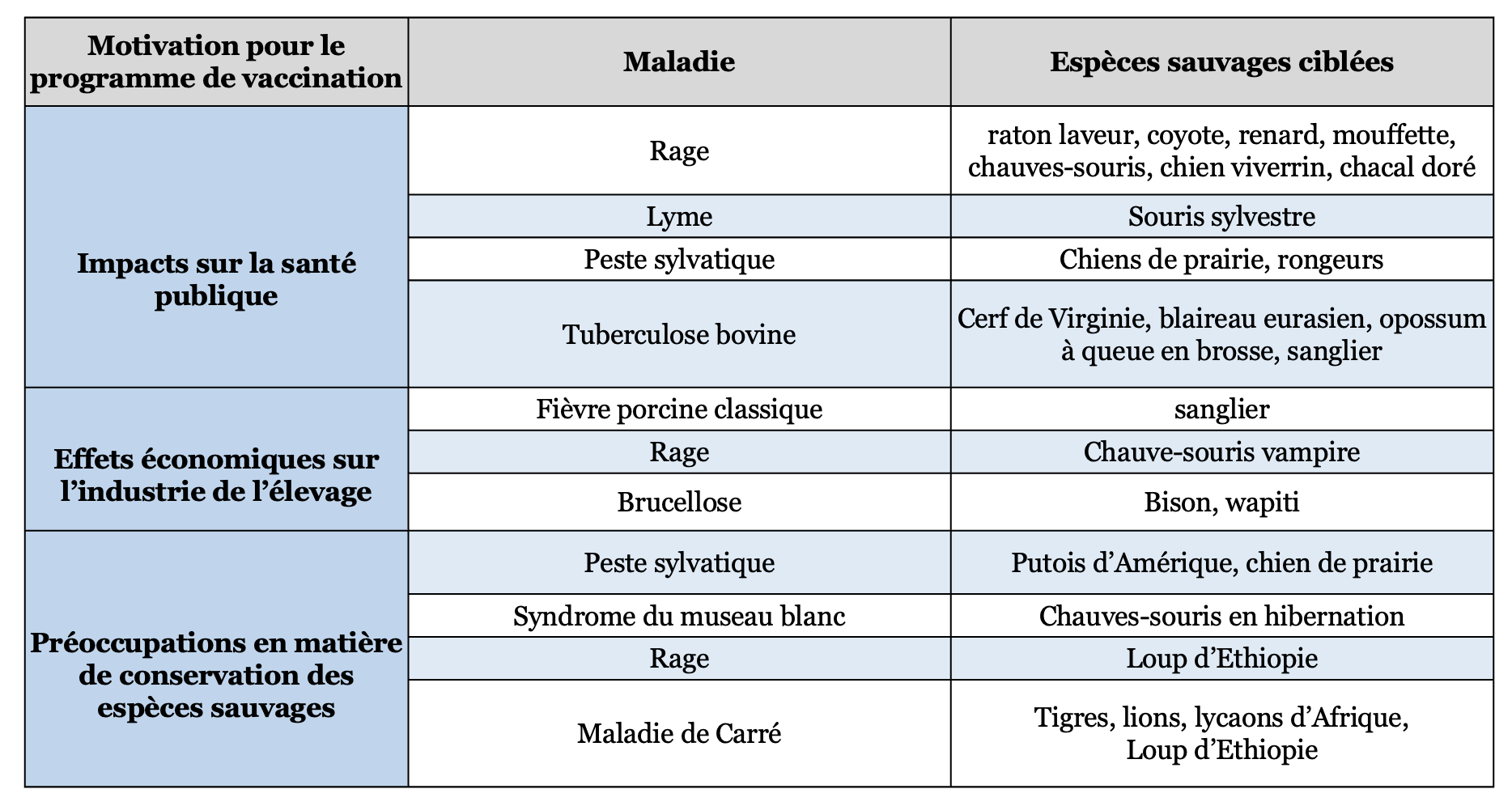
La vaccination de la faune sauvage reste marginale mais stratégique. L’exemple de la rage, éradiquée en France grâce à la vaccination orale des renards, est emblématique. D’autres pathologies zoonotiques pourraient théoriquement faire l’objet de campagnes similaires (Tableau 3) (37). La mise en œuvre d’un programme de vaccination ciblant des populations d’animaux sauvages requiert en amont un important travail de recherche visant à identifier le candidat vaccin présentant le meilleur compromis entre innocuité et efficacité, à optimiser la formulation galénique de l’appât – les vaccins ne pouvant être pour des conditions pratiques que des vaccins oraux – afin d’en maximiser l’attractivité pour les animaux, et à définir une stratégie de distribution à la fois efficiente et économiquement soutenable. Les choix technologiques et opérationnels doivent intégrer les spécificités écologiques, éthologiques et spatiales de l’espèce cible. Il faut pouvoir identifier la cible la plus simple à atteindre, qui n’est pas forcément celle directement responsable de la transmission d’une infection à l’homme.
Ainsi, si théoriquement la vaccination des grands singes pourrait prévenir les épidémies humaines causées par la transmission du virus à l’homme, la vaccination de ces animaux pose des problèmes logistiques et éthiques. Dès lors il a été envisagé de cibler les chauve-souris, espèce en amont de la chaine de transmission et plus facilement accessible, en leur appliquant sur le corps après capture un vaccin enduit de vaseline. Le contact étroit entre les chauves-souris porteuses et les autres chauves-souris permettrait ainsi la diffusion du vaccin, celui étant absorbé par les animaux lors de leur toilette (38). Par ailleurs, toute utilisation de vaccins en milieu ouvert est soumise à l’autorisation préalable des autorités compétentes, afin de prévenir les risques potentiels pour les écosystèmes et les espèces non ciblées (39).
Prévention des zoonoses : cibler les arthropodes
Parmi les anthropozoonoses, les maladies à transmission vectorielle sont un enjeu majeur de santé publique, tant humaine qu’animale. Elles représentent 17% de l’ensemble des infections à l’échelle de la planète. Les arthropodes, tels que les moustiques, les tiques, les phlébotomes ou encore les mouches tsé-tsé, jouent un rôle central comme vecteurs dans la transmission de pathogènes viraux, bactériens et parasitaires. À côté des stratégies de vaccination contre les pathogènes eux-mêmes, des stratégies vaccinales contre les arthropodes se sont mises en place.
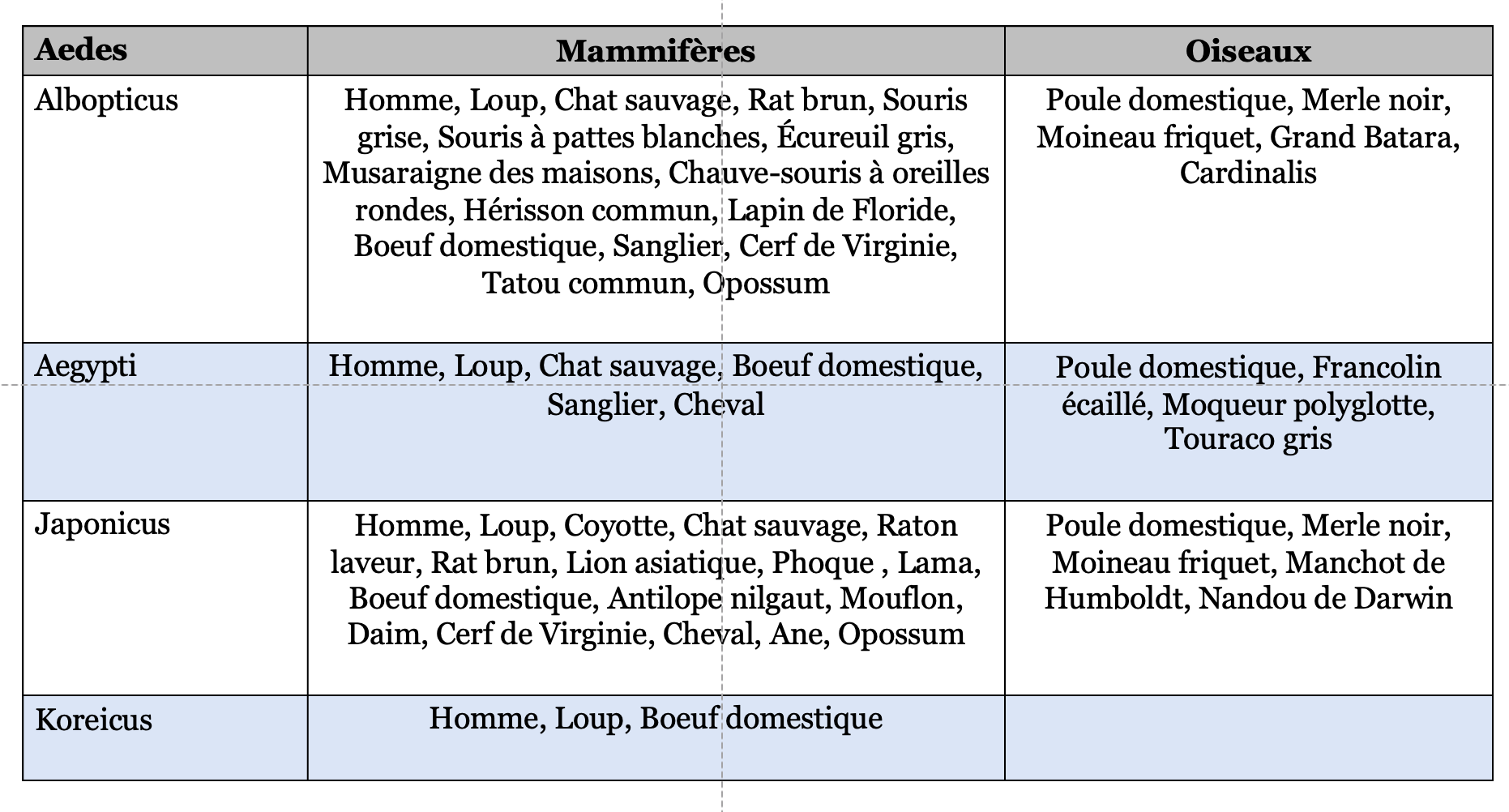
Les outils traditionnels de lutte contre ces vecteurs sont confrontés à des phénomènes de résistance aux agents chimiques ou aux conséquences environnementales néfastes de leur utilisation large (40). L’objectif de la vaccination contre les arthropodes est de bloquer le cycle de transmission des agents pathogènes avant qu’ils ne puissent infecter l’hôte vertébré. Cette approche repose sur le développement d’une immunité contre des antigènes dérivés du vecteur (salive, intestin, cuticule) qui interfèrent avec son aptitude vectorielle avec, comme conséquences potentielles, une réduction de la charge microbiologique de l’arthropode, une altération de son comportement d’alimentation, une diminution de sa survie ou de sa fécondité (41). Si les vecteurs anti-arthropodes représentent une stratégie intéressante – les arthropodes étant largement partagés par les hommes et les animaux (voire l’exemple pour les aedes dans le Tableau 4) – force est de constater qu’il n’existe actuellement que très peu de vaccins de ce type sur le marché (41). Seuls des vaccins ciblant la protéine Bm86 des tiques Boophilus microplus (TickGARD® et Gavac®) sont disponibles en médecine vétérinaire.
La recherche vaccinale contre les Aedes et les anophèles (moustiques vecteurs de la dengue, du Zika, du chikungunya, de la fièvre jaune et du paludisme) est plus récente (42). Des vaccins de nouvelle génération, combinant antigènes du pathogène et du vecteur, sont en cours de développement (43). La vaccination anti-arthropode s’inscrit pleinement dans une approche One Health. Elle représente une piste complémentaire particulièrement pertinente dans les contextes d’émergence, où le vecteur est souvent présent avant que la circulation du pathogène ne soit détectée. Cependant, cette approche comporte également des défis, qu’ils soient techniques (variabilité antigénique entre espèces de vecteurs et entre populations géographiques ou complexité/méconnaissance de la réponse immunitaire à des antigènes vectoriels, souvent mal conservés) ou socio-économiques (inconnues sur l’acceptabilité de vaccins à bénéfice indirect, notamment en santé humaine, positionnement économique).
Vaccination et lutte contre l’antibiorésistance
La vaccination joue également un rôle clé dans la lutte contre l’antibiorésistance. On estime que 65 à 75% des antibiotiques sont prescrits en médecine humaine et 25 à 35% sont destinés à l’usage vétérinaire. L’antibiorésistance résulte notamment de l’utilisation inappropriée des antibiotiques tant en médecine humaine (usage excessif, notamment pour des infections virales ou en automédication, arrêt trop précoce des traitements…) qu’en médecine vétérinaire (utilisation en prophylaxie, stimulation de croissance …). La vaccination fait partie des armes potentiellement efficaces pour lutter contre l’antibiorésistance. Plusieurs exemples de l’impact de la vaccination sur la résistance aux antibiotiques existent avec des vaccins humains – diminution significative des souches β-lactamase-positives après l’introduction vaccination contre l’Haemophilus Influenzae (45), diminution significative des souches résistances à la pénicilline après l’introduction vaccination contre le pneumocoque (46) – et de nombreux vaccins sont en cours de développement avec cet objectif (47). Si le potentiel existe également en vaccination vétérinaire (48), aucun vaccin n’est actuellement développé/utilisé dans cette perspective.
Apports vétérinaires à l’innovation vaccinale humaine
Les connaissances accumulées en vaccination animale sont potentiellement déterminantes pour la vaccination humaine. Plusieurs plateformes vaccinales sont disponibles chez l’animal alors qu’elles l’ont été plus tardivement ou ne le sont toujours pas chez l’homme, comme les vaccins ADN (49) ou les vecteurs viraux (50). La compréhension des mécanismes immunologiques impliqués dans la protection contre les coronavirus animaux et les vaccins développés chez eux ont été des facteurs permettant d’avancer rapidement dans la mise au point de vaccin contre le covid-19 (51). L’étude de la réponse immunitaire après infections par les coronavirus animaux mettait notamment ainsi en évidence : la nécessité d’une réponse anticorps et lymphocytaire T pour assurer la protection, la nature rapidement décroissante de la réponse immunitaire notamment humorale, le rôle parfois délétère de cette réponse immunitaire avec comme modèle l’infection par le virus de la péritonite infectieuse du chat avec un phénomène d’ADE (antibody dependant enhancement) aboutissant à une propagation de l’infection via l’infection des macrophages.
Nouvelles pistes : maladies non transmissibles et innovation
Des stratégies de vaccination peuvent également être envisagées en dehors du contexte des pathologies non infectieuses et sont par exemple développées dans celui des maladies allergiques. Un exemple original concerne ici l’allergie au poil de chat. Cette allergie toucherait entre 10 à 30% de la population occidentale. On a décrit 10 allergènes de Feline domesticus (Feld). Feld1, étant considéré comme le principal, 94% des patients allergiques aux chats ayant des IgE spécifiques contre celui-ci. Dans ce contexte, des auteurs ont développé un vaccin visant à induire des anticorps anti Feld1 chez des chats qui ont alors reçu trois injections de 100 µg de Fel-CuMV, cependant qu’on appréciait chez leurs propriétaires l’évolution des symptômes allergiques (52). Le vaccin s’est avéré immunogénique mais avec, pour l’instant, assez peu d’impact clinique.
Conclusion
L’approche One Health, en intégrant les dimensions humaine, animale et environnementale de la santé, offre un cadre unique pour repenser la stratégie vaccinale à l’échelle mondiale. Loin de se limiter à la prévention des zoonoses, cette approche permet d’élargir les bénéfices de la vaccination à la sécurité alimentaire, à la lutte contre l’antibiorésistance, à la préservation des écosystèmes, voire à certaines maladies non transmissibles. Pourtant, malgré son potentiel, la mise en œuvre concrète d’une vaccination One Health reste encore trop souvent marginale, fragmentée ou freinée par des obstacles techniques, réglementaires, économiques et institutionnels. Les exemples de la rage ou de la fièvre de la vallée du Rift montrent que des stratégies coordonnées, parfois avec des vaccins distincts ou communs, peuvent être efficaces lorsqu’elles sont bien conçues et adaptées au contexte local.
Le développement d’outils innovants, la prise en compte des spécificités écologiques, l’implication des acteurs de terrain et la coopération intersectorielle seront essentiels pour faire de la vaccination One Health une réalité opérationnelle. Il s’agit moins d’un idéal à atteindre que d’une nécessité à mettre en œuvre pour répondre aux défis sanitaires complexes du XXIe siècle, tout en gardant à l’esprit que préserver les santés animale et environnementale pour elles-mêmes et non pas uniquement pour leur impact sur la santé humaine, doit être aussi un objectif clair de ce type d’approche.
Notes et références de l’article
- Lynn, David J., Saoirse C. Benson, Miriam A. Lynn, et Bali Pulendran. «Modulation of Immune Responses to Vaccination by the Microbiota: Implications and Potential Mechanisms». Nature Reviews Immunology 22, no 1 (janvier 2022): 33-46. https://doi.org/10.1038/s41577-021-00554-7.
- Trinh, Pauline, Jesse R. Zaneveld, Sarah Safranek, et Peter M. Rabinowitz. «One Health Relationships Between Human, Animal, and Environmental Microbiomes: A Mini-Review». Frontiers in Public Health 6 (30 août 2018): 235. https://doi.org/10.3389/fpubh.2018.00235.
- Selter, Felicitas, et Sabine Salloch. «Whose Health and Which Health? Two Theoretical Flaws in the One Health Paradigm». Bioethics 37, no 7 (septembre 2023): 674-82. https://doi.org/10.1111/bioe.13192.
- https://www.visualcapitalist.com/all-the-biomass-of-earth-in-one-graphic/
- https://ourworldindata.org/wild-mammals-birds-biomass
- https://nielseniq.com/global/en/insights/report/2016/mans-best-friend-global-pet-ownership-and-feeding-trends/
- Draper, Simon J., et Jonathan L. Heeney. «Viruses as Vaccine Vectors for Infectious Diseases and Cancer». Nature Reviews Microbiology 8, no 1 (janvier 2010): 62-73. https://doi.org/10.1038/nrmicro2240.
- Paillot, Romain, Christel Marcillaud Pitel, Xavier D’Ablon, et Stéphane Pronost. «Equine Vaccines: How, When and Why? Report of the Vaccinology Session, French Equine Veterinarians Association, 2016, Reims». Vaccines 5, no 4 (4 décembre 2017): 46. https://doi.org/10.3390/vaccines5040046.
- Warimwe, George M., Michael J. Francis, Thomas A. Bowden, Samuel M. Thumbi, et Bryan Charleston. «Using Cross-Species Vaccination Approaches to Counter Emerging Infectious Diseases». Nature Reviews Immunology 21, no 12 (décembre 2021): 815-22. https://doi.org/10.1038/s41577-021-00567-2.
- https://www.woah.org/app/uploads/2021/06/plan-daction-mondial-contre-la-peste-bovine-2018.pdf
- https://www.weforum.org/stories/2022/07/zoonotic-disease-virus-covid/
- Chomel, B.B. «Zoonoses». In Encyclopedia of Microbiology, 820-29. Elsevier, 2009. https://doi.org/10.1016/B978-012373944-5.00213-3.
- Messenger, Ali M., Amber N. Barnes, et Gregory C. Gray. «Reverse Zoonotic Disease Transmission (Zooanthroponosis): A Systematic Review of Seldom-Documented Human Biological Threats to Animals». Édité par Bradley S. Schneider. PLoS ONE 9, no 2 (28 février 2014): e89055. https://doi.org/10.1371/journal.pone.0089055.
- Ash, A., A. Lymbery, J. Lemon, S. Vitali, et R.C.A. Thompson. «Molecular Epidemiology of Giardia Duodenalis in an Endangered Carnivore – The African Painted Dog». Veterinary Parasitology 174, no 3-4 (décembre 2010): 206-12. https://doi.org/10.1016/j.vetpar.2010.08.034.
- Nelson, Martha I., et Amy L. Vincent. «Reverse Zoonosis of Influenza to Swine: New Perspectives on the Human–Animal Interface». Trends in Microbiology 23, no 3 (mars 2015): 142-53. https://doi.org/10.1016/j.tim.2014.12.002.
- Ewers, Christa, Mirjam Grobbel, Ivonne Stamm, Peter A. Kopp, Ines Diehl, Torsten Semmler, Angelika Fruth, et al. «Emergence of Human Pandemic O25:H4-ST131 CTX-M-15 Extended-Spectrum-β-Lactamase-Producing Escherichia Coli among Companion Animals». Journal of Antimicrobial Chemotherapy 65, no 4 (avril 2010): 651-60. https://doi.org/10.1093/jac/dkq004.
- Krammer, Florian, Enikö Hermann, et Angela L. Rasmussen. «Highly Pathogenic Avian Influenza H5N1: History, Current Situation, and Outlook». Édité par Herman W. Favoreel. Journal of Virology, 27 mars 2025, e02209-24. https://doi.org/10.1128/jvi.02209-24.
- Peacock, Thomas P., Louise Moncla, Gytis Dudas, David VanInsberghe, Ksenia Sukhova, James O. Lloyd-Smith, Michael Worobey, Anice C. Lowen, et Martha I. Nelson. «The Global H5N1 Influenza Panzootic in Mammals». Nature 637, no 8045 (9 janvier 2025): 304-13. https://doi.org/10.1038/s41586-024-08054-z.
- https://openknowledge.fao.org/items/7c07dfba-99a6-4a1c-8218-94156527f405
- Poetri, Okti Nadia, Michiel Van Boven, Ivo Claassen, Guus Koch, I.Wayan Wibawan, Arjan Stegeman, Jan Van Den Broek, et Annemarie Bouma. «Silent Spread of Highly Pathogenic Avian Influenza H5N1 Virus amongst Vaccinated Commercial Layers». Research in Veterinary Science 97, no 3 (décembre 2014): 637-41. https://doi.org/10.1016/j.rvsc.2014.09.013.
- Cattoli, Giovanni, Alice Fusaro, Isabella Monne, Fethiye Coven, Tony Joannis, Hatem S. Abd El-Hamid, Aly Ahmed Hussein, et al. «Evidence for Differing Evolutionary Dynamics of A/H5N1 Viruses among Countries Applying or Not Applying Avian Influenza Vaccination in Poultry». Vaccine 29, no 50 (novembre 2011): 9368-75. https://doi.org/10.1016/j.vaccine.2011.09.127.
- Vergne, Timothée, Vladimir Grosbois, Yilma Jobre, Ahmed Saad, Amira Abd El Nabi, Shereen Galal, Mohamed Kalifa, et al. «Avian Influenza Vaccination of Poultry and Passive Case Reporting, Egypt». Emerging Infectious Diseases 18, no 12 (décembre 2012): 2076-78. https://doi.org/10.3201/eid1812.120616.
- Pongcharoensuk, P., W. Adisasmito, L. M. Sat, P. Silkavute, L. Muchlisoh, P. Cong Hoat, et R. Coker. «Avian and Pandemic Human Influenza Policy in South-East Asia: The Interface between Economic and Public Health Imperatives». Health Policy and Planning 27, no 5 (1 août 2012): 374-83. https://doi.org/10.1093/heapol/czr056.
- Zeng, Xianying, Guobin Tian, Jianzhong Shi, Guohua Deng, Chengjun Li, et Hualan Chen. «Vaccination of Poultry Successfully Eliminated Human Infection with H7N9 Virus in China». Science China Life Sciences 61, no 12 (décembre 2018): 1465-73. https://doi.org/10.1007/s11427-018-9420-1.
- Zou, Lin, Chong Zhang, Jianming Zhang, Jianguo Wang, Ling Tong, Lu Xi, Xiao Liu, et al. «Surveillance of H7N9 Avian Influenza Virus in Farmers’ Markets in Beijing in 2019–2023». One Health Advances 3, no 1 (20 février 2025): 3. https://doi.org/10.1186/s44280-025-00069-z.
- Cattoli, Giovanni, Alice Fusaro, Isabella Monne, Fethiye Coven, Tony Joannis, Hatem S. Abd El-Hamid, Aly Ahmed Hussein, et al. «Evidence for Differing Evolutionary Dynamics of A/H5N1 Viruses among Countries Applying or Not Applying Avian Influenza Vaccination in Poultry». Vaccine 29, no 50 (novembre 2011): 9368-75. https://doi.org/10.1016/j.vaccine.2011.09.127.
- https://agriculture.gouv.fr/tout-ce-quil-faut-savoir-sur-le-plan-daction-vaccination-iahp-en-france
- EFSA Panel on Animal Health and Animal Welfare (AHAW), ECDC, Julio Alvarez, Anette Boklund, Sabine Dippel, Fernanda Dórea, Jordi Figuerola, et al. «Preparedness, Prevention and Control Related to Zoonotic Avian Influenza». EFSA Journal 23, no 1 (janvier 2025). https://doi.org/10.2903/j.efsa.2025.9191.
- https://cdn.who.int/media/docs/default-source/consultation-rdb/2.licensed-and-stockpiled-vaccines.pdf?sfvrsn=845c87b2_3des H5 R&D.pptx
- Lembo, Tiziana, Katie Hampson, Magai T. Kaare, Eblate Ernest, Darryn Knobel, Rudovick R. Kazwala, Daniel T. Haydon, et Sarah Cleaveland. «The Feasibility of Canine Rabies Elimination in Africa: Dispelling Doubts with Data». Édité par Charles E. Rupprecht. PLoS Neglected Tropical Diseases 4, no 2 (23 février 2010): e626. https://doi.org/10.1371/journal.pntd.0000626.
- Freuling, Conrad M., Katie Hampson, Thomas Selhorst, Ronald Schröder, Francois X. Meslin, Thomas C. Mettenleiter, et Thomas Müller. «The Elimination of Fox Rabies from Europe: Determinants of Success and Lessons for the Future». Philosophical Transactions of the Royal Society B: Biological Sciences 368, no 1623 (5 août 2013): 20120142. https://doi.org/10.1098/rstb.2012.0142.
- Alkan, Cigdem, Eduardo Jurado-Cobena, et Tetsuro Ikegami. «Advancements in Rift Valley Fever Vaccines: A Historical Overview and Prospects for next Generation Candidates». Npj Vaccines 8, no 1 (4 novembre 2023). https://doi.org/10.1038/s41541-023-00769-w.
- Warimwe, George M., Joseph Gesharisha, B. Veronica Carr, Simeon Otieno, Kennedy Otingah, Danny Wright, Bryan Charleston, et al. «Chimpanzee Adenovirus Vaccine Provides Multispecies Protection against Rift Valley Fever». Scientific Reports 6, no 1 (5 février 2016). https://doi.org/10.1038/srep20617.
- Jenkin, Daniel, Daniel Wright, Pedro M Folegatti, Abigail Platt, Ian Poulton, Alison Lawrie, Nguyen Tran, et al. «Safety and Immunogenicity of a ChAdOx1 Vaccine against Rift Valley Fever in UK Adults: An Open-Label, Non-Randomised, First-in-Human Phase 1 Clinical Trial». The Lancet Infectious Diseases 23, no 8 (août 2023): 956-64. https://doi.org/10.1016/s1473-3099(23)00068-3.
- Warimwe, George M., Michael J. Francis, Thomas A. Bowden, Samuel M. Thumbi, et Bryan Charleston. «Using Cross-Species Vaccination Approaches to Counter Emerging Infectious Diseases». Nature Reviews Immunology 21, no 12 (décembre 2021): 815-22. https://doi.org/10.1038/s41577-021-00567-2.
- Wirblich, Christoph, Christopher M. Coleman, Drishya Kurup, Tara S. Abraham, John G. Bernbaum, Peter B. Jahrling, Lisa E. Hensley, Reed F. Johnson, Matthew B. Frieman, et Matthias J. Schnell. «One-Health: A Safe, Efficient, Dual-Use Vaccine for Humans and Animals against Middle East Respiratory Syndrome Coronavirus and Rabies Virus». Édité par Adolfo García-Sastre. Journal of Virology 91, no 2 (15 janvier 2017): e02040-16. https://doi.org/10.1128/JVI.02040-16.
- https://cwhl.vet.cornell.edu/article/wildlife-vaccination-growing-feasibility
- Fausther-Bovendo, Hugues, Sabue Mulangu, et Nancy J Sullivan. «Ebolavirus Vaccines for Humans and Apes». Current Opinion in Virology 2, no 3 (juin 2012): 324-29. https://doi.org/10.1016/j.coviro.2012.04.003.
- Barnett, K.M., et David J. Civitello. «Ecological and Evolutionary Challenges for Wildlife Vaccination». Trends in Parasitology 36, no 12 (décembre 2020): 970-78. https://doi.org/10.1016/j.pt.2020.08.006.
- Mansouri, Ahlem, Mickael Cregut, Chiraz Abbes, Marie-Jose Durand, Ahmed Landoulsi, et Gerald Thouand. «The Environmental Issues of DDT Pollution and Bioremediation: A Multidisciplinary Review». Applied Biochemistry and Biotechnology 181, no 1 (janvier 2017): 309-39. https://doi.org/10.1007/s12010-016-2214-5.
- De La Fuente, José, et Agustín Estrada-Peña. «Why New Vaccines for the Control of Ectoparasite Vectors Have Not Been Registered and Commercialized?» Vaccines 7, no 3 (28 juillet 2019): 75. https://doi.org/10.3390/vaccines7030075.
- Gonçalves, Daniel, et Patrick Hunziker. «Transmission-Blocking Strategies: The Roadmap from Laboratory Bench to the Community». Malaria Journal 15, no 1 (décembre 2016): 95. https://doi.org/10.1186/s12936-016-1163-3.
- Ojha, Rupal, Rajan Kumar Pandey, et Vijay Kumar Prajapati. «Vaccinomics Strategy to Concoct a Promising Subunit Vaccine for Visceral Leishmaniasis Targeting Sandfly and Leishmania Antigens». International Journal of Biological Macromolecules 156 (août 2020): 548-57. https://doi.org/10.1016/j.ijbiomac.2020.04.097.
- Cebrián-Camisón S, Martínez-de la Puente J, et Figuerola J «A Literature Review of Host Feeding Patterns of Invasive Aedes Mosquitoes in Europe» Insects 2020 Nov 29;11(12):848. doi: 10.3390/insects11120848.
- Heilmann KP, Rice CL, Miller AL et al «Decreasing prevalence of beta-lactamase production among respiratory tract isolates of Haemophilus influenzae in the United States». Antimicrob Agents Chemother 2005 Jun;49(6):2561-4.doi: 10.1128/AAC.49.6.2561-2564.2005.
- Jansen K , Knirsch C, Anderson AL «The role of vaccines in preventing bacterial antimicrobial resistance» Nat Medicine, 2018 Jan 9;24(1):10-19. doi: 10.1038/nm.4465.
- Micoli F, Bagnoli F, Rappuoli R, Serruto D «The role of vaccines in combatting antimicrobial resistance» Nat Rev Microbiol, 2021 May;19(5):287-302. doi: 10.1038/s41579-020-00506-3..
- https://www.woah.org/app/uploads/2021/09/ahg-amur-vaccines-ruminants-may2018.pdf
- Pereira V, Zurita-Turk M, Saraiva T et al «DNA Vaccines Approach: From Concepts to Applications» World Journal of Vaccines (2014) 04(02) 50-71 doi: 10.4236/wjv.2014.42008
- Draper S & Heeney J «Viruses as vaccine vectors for infectious diseases and cancer» Nat Rev Microbiol, 2010 Jan;8(1):62-73. doi: 10.1038/nrmicro2240.
- https://www.has-sante.fr/jcms/p_3221567/fr/aspects-immunologiques-et-virologiques-de-l-infection-par-le-sars-cov-2
- Thoms F, Haas S, Erhart A et al, «Immunization of Cats against Fel d 1 Results in Reduced Allergic Symptoms of Owners» Viruses, 2020 Mar 6;12(3):288. doi: 10.3390/v12030288.
