Dire que le Messe Wien Center est un centre de congrès avec de l’espace est un euphémisme, tant le centre des congrès, à quelques foulées du Danube, est gigantesque, avec ses espaces de convivialité, d’échanges et ceux dédiés aux laboratoires pharmaceutiques. On peut même s’y faire photographier avec accessoires festifs sur fond de l’opéra national de Vienne (document non fourni). À vue de nez, on doit frôler les 10000 congressistes. Le Congrès européen est devenu mondial et a pris de l’embonpoint avec la crise covidCovid-19 Une maladie à coronavirus, parfois désignée covid (d'après l'acronyme anglais de coronavirus disease) est une maladie causée par un coronavirus (CoV). L'expression peut faire référence aux maladies suivantes : le syndrome respiratoire aigu sévère (SRAS) causé par le virus SARS-CoV, le syndrome respiratoire du Moyen-Orient (MERS) causé par le virus MERS-CoV, la maladie à coronavirus 2019 (Covid-19) causée par le virus SARS-CoV-2. et la fin de la trop américaine Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC). Trump II va sans doute renforcer la présence américaine qui y est déjà importante.
Le VRS est l’un des virus respiratoires saisonniers – avec la grippe, le métapneumovirus, le SARS-CoV-2— qui pèse le plus sur le système de soins. Chez le nourrisson, mais aussi chez l’adulte. Dans 60 à 90% des cas de bronchiolite chez le nourrisson, l’agent infectieux responsable est le VRS. Chaque année, près de 30% des enfants de moins de 2 ans contractaient une bronchiolite, soit environ 480 000 cas par an. Et 2 à 3% des nourrissons de moins de un an sont hospitalisés pour une bronchiolite plus sévère.
Chez les personnes plus âgées, le VRS peut induire des complications respiratoires graves (syndrome de détresse respiratoire aiguë, exacerbation d’une maladie chronique cardiopulmonaire ou pneumopathie nécessitant une assistance respiratoire en réanimation) susceptibles de conduire au décès. Chaque hiver, ce sont 15 000 à 20 000 personnes âgées qui sont hospitalisées en France à cause du VRS et plusieurs milliers en meurent.
Dans l’attente d’antiviraux (cf. infra), deux stratégies visant à limiter les effets dévastateurs du VRS sont mises en place durant la saison de circulation du VRS: l’immunisation par un anticorps monoclonal (ACMC, nirsévimab/BEFORTUS pour l’heure) ou la vaccination (deux vaccins ont obtenu leur AMMAMM Autorisation de Mise sur le Marché. Procédure administrative qui autorise un laboratoire pharmaceutique à commercialiser une molécule. européenne, AREXVY de GSK – remboursé dans les indications de la HAS – et ABRYSVO de Pfizer – non encore remboursé – en attendant le vaccin ARNm de Moderna en approche). Pour l’enfant à naître, ces deux stratégies sont possibles : la vaccination des mères pendant la grossesse ou l’immunisation par anticorps monoclonaux des nouveau-nés et des nourrissons. Cette alternative sans précédent en maladies infectieuses est laissée au choix des parents. Ce qui nécessite des efforts de pédagogie. Pour l’adulte, la HAS a en juillet 2024 déterminé la population cible en dehors de la femme enceinte : les personnes de 75 ans et plus et celles de plus de 65 ans présentant des pathologies respiratoires ou cardiaques chroniques.
Epidémiologie européenne du VRS
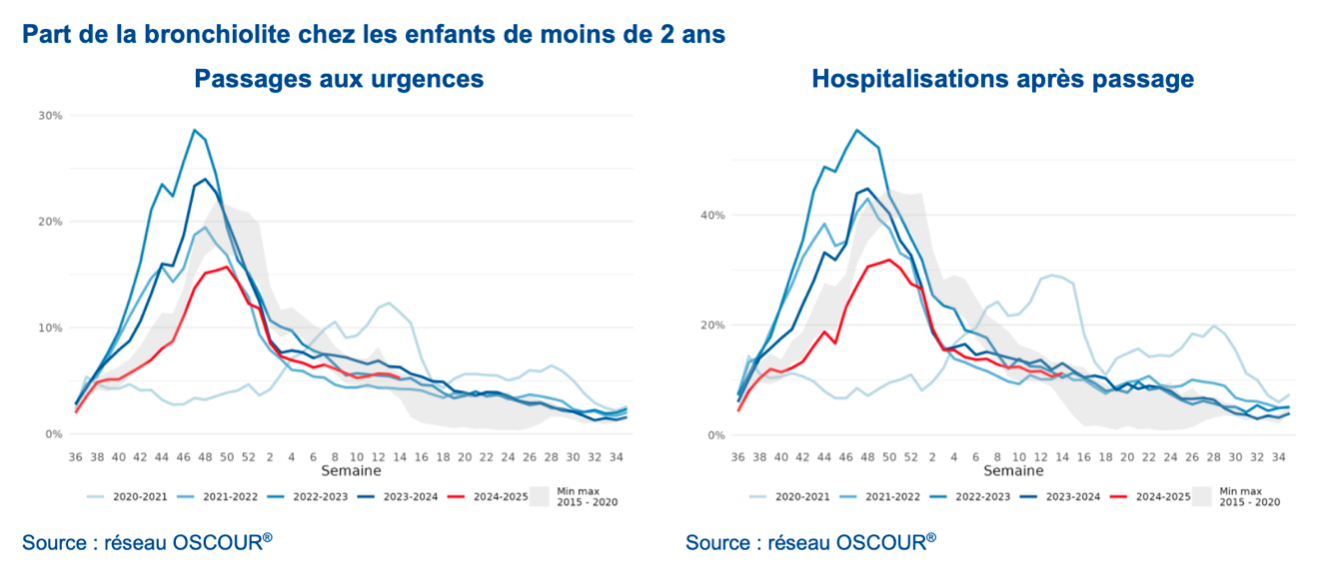
Pour se convaincre de l’intérêt global envers ce virus respiratoire à l’ESCMID 2025, il fallait être à la session EW 041 Hall 13 à 8h30, premier jour du congrès proprement dit, qui était full. Eeva Broberg (ECDC, WO 128) a dressé une vue de l’épidémiologie européenne 2020-2025 du VRS et du fardeau de cette infection en Europe: 245 244 admissions par an d’enfants de moins de 5 ans, 1,8% des enfants européens sans facteur de risque (prématurité, immunodéficience, trisomie 21) seront hospitalisés la première année de vie, 3 049 039 cas chez les plus de 60 ans (sous-estimés) et 19 527 décès à l’hôpital dans cette tranche d’âge. Avec des données actualisées à la semaine 13 de 2025 : 7% de positivité dans 20 pays. Les courbes comparées des hivers – le pic de VRS se situe entre Noël et jour de l’an – démontre un retour à l’ère pré-pandémique tel qu’observée l’hiver 2020-2021 avec une co-circulation de la grippe et du covid-19Covid-19 Une maladie à coronavirus, parfois désignée covid (d'après l'acronyme anglais de coronavirus disease) est une maladie causée par un coronavirus (CoV). L'expression peut faire référence aux maladies suivantes : le syndrome respiratoire aigu sévère (SRAS) causé par le virus SARS-CoV, le syndrome respiratoire du Moyen-Orient (MERS) causé par le virus MERS-CoV, la maladie à coronavirus 2019 (Covid-19) causée par le virus SARS-CoV-2. (Figure 1).
Édition nationale / Publication : 9 avril 2025 / p. 9
En matière d’ACMC, Louis Bont (WO 129 ; Utrecht, Pays-Bas) a révélé le pays de référence en matière de couverture préventive du VRS: le Chili. Son programme national d’immunisation par le nirsévimab a permis en 2024 une couverture de 83-98% des enfants de moins de 4 ans, la distribution de 93 373 doses se traduisant par une réduction de 86% des admissions en soins intensifs et de 75% d’hospitalisations avec zéro décès versus 13 en 2023! Ce pédiatre a aussi décliné les possibles ACMC de seconde génération: clesrovimab (MK 1654), un long acting prometteur de Merck et le suptavumab (REGN2222), serpent de mer en phase III, ainsi que la poussée des antiviraux directs qui viendraient refermer l’étau contre le VRS : Ziresovir (ArkBio) en phase III, avec de bons résultats, Sisunatovir (Pfizer) « programme terminé » selon la présentation orale et Zelicapavir (Enanta) en phase II. La couverture immunisante en France par le nisevimab et les données socio-démographiques ont été récemment publiées1Salomé Boutin et al. Sociodemographic Characteristics of Infants Receiving Nirsevimab. JAMA Network Open Research Letter Pediatrics, April 9, 2025 : https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2832323 ainsi qu’une grande étude cas/contrôle de ses effets protecteurs, étude que l’on doit au groupe EPIPHARE2Marie Joelle Jabagi et al. Nirsevimab Effectiveness at Preventing RSV-Related Hospitalization in Infants. NEJM Evid 2025;4(3) : https://evidence.nejm.org/doi/10.1056/EVIDoa2400275. Ainsi que des recommandations HAS.
«Progrès dans l’efficacité des vaccins contre les infections respiratoires»
Même affluence Hall 9 à 11 h pour la session LB 001: «Advances in vaccine effectiveness for respiratory infections» avec Jean-Paul Stahl (France) comme co-chair. L’occasion d’abandonner un temps le VRS pour revenir sur les coronavirus, avec Frances Priddy (Cambridge, USA L 0001) et le développement des vaccins ARNm de Moderna contre les variants JN.1 et KP-2 du SARS-CoV-2. De bons résultats en termes d’immunogénicité neutralisante, mais la diminution des titres d’anticorps contre les sous-variants qui suivent, KP.3.1.1, XEC et LP 8.1, laisse encore entrevoir des capacités d’échappement de ces variants.
Daniel Jenkin (Oxford Vaccine Group, L0004) nous a emmenés vers le très oublié des coronavirus, le MERS responsable du syndrome respiratoire du Moyen-Orient, à forte mortalité, avec le développement d’un vaccin ChAdOx1 prometteur avec une bonne réponse immune. Même chez les personnes qui ont déjà été exposées au même vecteur (adénovirus) utilisé dans nombre de vaccins, dont celui contre le covid développé précisément par l’université d’Oxford. En espérant que la destinée de ce vaccin VRS soit meilleure que son équivalent contre le covid, notamment en termes de stabilité de la protéine vaccinale.
C’est dans ce contexte de triple réponse (ACMC, vaccin puis un jour antiviraux) que se pose la question centrale de la pression de sélection et de la sortie de variants du VRS résistant notamment à nirsévimab. Le nirsévimab cible en effet un site antigénique spécifique (l’épitope Ø) sur une protéine située à la surface du VRS impliquée dans la multiplication virale – la protéine de fusion F – et bloque ainsi le virus. Il existe un risque théorique d’émergence de variants du VRS portant des mutations de résistance à la neutralisation par le nirsévimab, même en absence de pression de sélection par l’anticorps. Le VRS est, en effet, comme tout virus à ARN, un virus variable et ce risque pourrait augmenter avec l’utilisation préventive généralisée du nirsévimab. Comme ce fut le cas pour le virus du covid.
L’étude POLYRES
C’est pour cela que la présentation orale du Pr Slim Fourati, responsable de l’unité de Virologie-virus respiratoires au CHU Henri Mondor, InsermInserm Institut national de la recherche médicale. U955, s’est retrouvée dans le top 10 des communications orales du 12 avril. Travaux portant sur la «Caractérisation moléculaire des infections par le VRS chez les patients âgés au cours de la saison 2023/2024» et fruit d’une collaboration AP-HPAP-HP Assistance publique-Hôpitaux de Paris. Inserm, Université Paris-Est-Créteil (UPEC) Institut Pasteur et bénéficiant d’un financement de l’ANRS-MIE dans le cadre du consortium EMERGEN. L’étude POLYRES, c’est son nom, présente les caractéristiques du virus respiratoire syncytial après traitement par le nirsévimab dans une étude observationnelle se déroulant en vie réelle au cours de la saison hivernale 2023-2024 comme déjà publiée en octobre 2024 et prolongée pendant l’hiver 2024-2025. Lors des essais cliniques de phase IIb/III, seuls 48 VRS ayant infecté des enfants sous traitement par le nirsévimab avaient pu être étudiés et des mutations d’échappement avaient été retrouvées chez deux d’entre eux. Dans cette étude menée entre septembre 2023 et mars 2024, 695 nourrissons âgés de moins d’un an infectés par le VRS et provenant de 31 hôpitaux français ont été inclus: 346 cas recevant du nirsévimab et 349 cas non exposés.
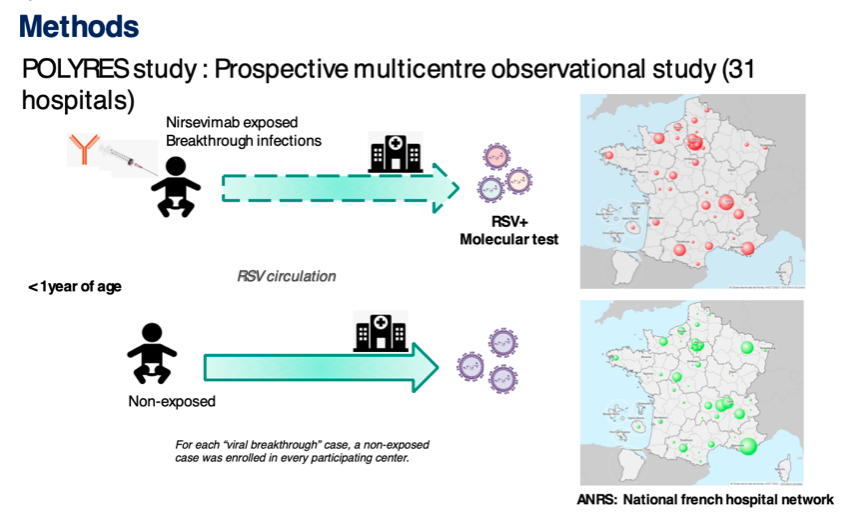
Le séquençage du génome complet du VRS a révélé la co-circulation de plusieurs lignées de VRS-A et de VRS-B dans les infections non exposées au nirsévimab et dans les cas survenant chez les exposés. Le VRS-A était majoritaire cette saison et a été retrouvé chez 87% des enfants infectés (N=472) et le VRS-B dans 13 % des cas. Les équipes ont analysé les caractéristiques des VRS-A et VRS-B présents dans les prélèvements nasopharyngés réalisés dans le cadre de la prise en charge habituelle des enfants. La séquence complète du génome viral a été déterminée pour rechercher en particulier des mutations dans le site de liaison (le site Ø) du nirsévimab (analyse génotypique). La capacité du nirsévimab à inhiber la multiplication des virus en culture cellulaire a également été étudiée (analyse phénotypique). L’analyse de 472 VRS-A (dont la moitié provenant d’enfants traités) n’a révélé aucune mutation de résistance au nirsévimab dans le site Ø de la protéine F. Dans les cas survenus chez les enfants exposés (breakthrough), tous les isolats de VRS-A restent sensibles au nirsévimab. Pour le VRS-B, l’équipe a identifié deux variants (2/24) hautement résistants au nirsévimab : (i) porteurs d’une mutation de résistance F:N208D et d’un double mutation F:I64M + F:K65E jamais décrite. Les tests d’inhibition de la fusion ont permis d’identifier ces deux profils mutationnels dans le VRS-B induisant une résistance à l’inhibition de la fusion par le nirsévimab, ce qui suggère un niveau élevé de résistance au nirsévimab. L’équipe a identifié le mécanisme moléculaire (en 3D) de cette résistance très rare, mais posant question. Au cours de la saison 2024-2025, environ 800 nourrissons ont été recrutés. Le séquençage et l’analyse phénotypique sont en cours, a-t-il été précisé.
Cette étude reste la plus vaste concernant des analyses virologiques d’échecs au nirsévimab à ce jour. Pour Slim Fourati, «la faible prévalencePrévalence Nombre de personnes atteintes par une infection ou autre maladie donnée dans une population déterminée. des mutations de résistance au nirsévimab chez des patients traités est rassurante. Toutefois, quelques VRS-B issus de patients traités analysés à ce jour présentaient des mutations d’échappement, ce qui invite à la prudence et souligne l’importance d’une surveillance moléculaire active dans le contexte d’une future utilisation du nirsévimab à l’échelle mondiale».

