Alors que deux essais cliniques majeurs ont conclu à l’inefficacité du tecovirimat contre le mpox, l’équipe de l’essai Unity a fait un choix audacieux : poursuivre l’évaluation de cette molécule jusqu’à son terme. Cette décision, annoncée en janvier 2025, intervient dans un contexte où la communauté scientifique s’interroge sur l’efficacité de ce médicament antiviral, largement utilisé depuis l’émergence du mpox hors de sa zone endémique en 2022.

Alexandra Calmy, directrice du centre de recherche clinique des hôpitaux universitaires de Genève et investigatrice principale de l’étude, est venue faire un point d’étape aux Journées scientifiques 2025 de l’ANRS-MIE.
L’essai Unity
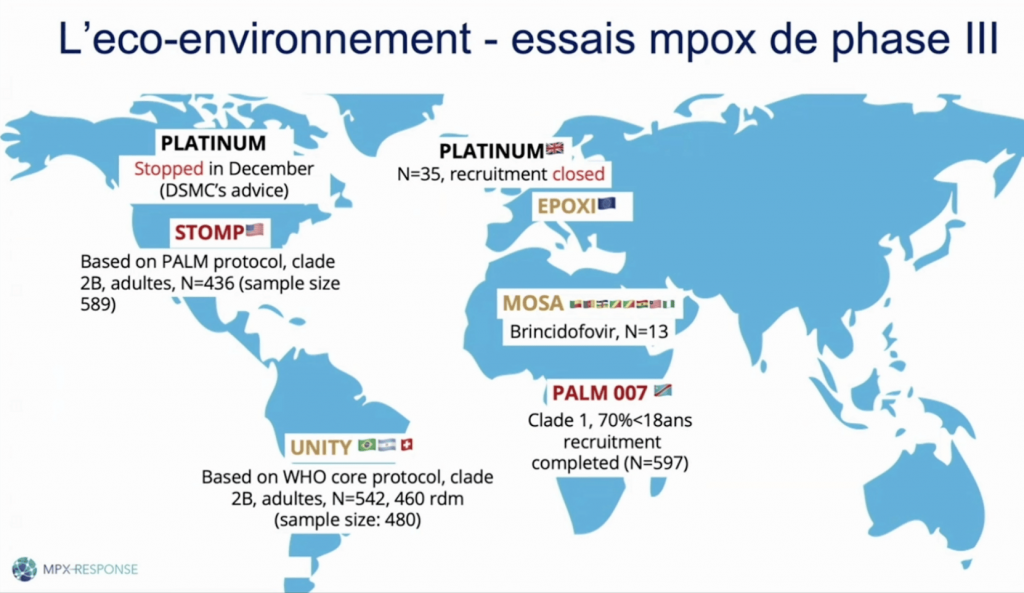
Unity est un essai clinique international de phase 3, multicentrique, randomisé, contrôlé par placeboPlacebo Substance inerte, sans activité pharmacologique, ayant la même apparence que le produit auquel on souhaite le comparer. (NDR rien à voir avec le groupe de rock alternatif formé en 1994 à Londres par Brian Molko et Stefan Olsdal.) et en double aveugleDouble aveugle L'étude avec répartition aléatoire, randomisé ou en double insu (ou en double aveugle) est une démarche expérimentale utilisée en recherche médicale et pharmaceutique faisant que ni le patient ni le médecin ne sait quel traitement est pris : traitement A ou B, traitement A ou placébo. évaluant l’efficacité du tecovirimat contre le mpox, ainsi que la sécurité de ce traitement antiviral chez les patients. Le critère principal d’évaluation de l’efficacité clinique est le temps nécessaire à la résolution de toutes les lésions visibles. Les critères secondaires incluent la mortalité, l’hospitalisation, les complications, la durée des symptômes et l’excrétion virale. La population étudiée comprend des adultes et des adolescents de plus de 14 ans atteints de mpox, quelle que soit la durée de la maladie.
L’étude Unity se déroule dans trois pays : la Suisse (Genève et Zurich, 10 patients), le Brésil (six sites ouverts, notamment Rio de Janeiro, 439 patients) et l’Argentine (deux sites à Buenos Aires, 20 patients). Le premier patient a été inclus au Brésil en mars 2023, mais il a fallu une année pour que chaque pays inclue son premier patient. La dynamique de recrutement a suivi les pics épidémiques, augmentant lors des périodes de forte incidence.

Au 31 mars 2025, 460 patients ont été inclus dans l’étude, dont 439 avec une PCRPCR "Polymerase Chain Reaction" en anglais ou réaction en chaîne par polymérase en français. Il s'agit d'une méthode de biologie moléculaire d'amplification d'ADN in vitro (concentration et amplification génique par réaction de polymérisation en chaîne), utilisée dans les tests de dépistage. confirmant le diagnostic de mpox. Par ailleurs, 97 patients ont été inclus dans un bras «open label» lorsque ces derniers nécessitaient un traitement et qu’une randomisation dans un bras placebo n’était pas souhaitable. Au total, 555 patients participent à l’étude. Le recrutement est prolongé jusqu’en septembre 2025.
L’analyse des caractéristiques des patients inclus au 20 mars 2025 (445 participants) révèle que :
- 98,9% sont des hommes
- 95% proviennent du Brésil
- 48,5% vivent avec le VIHVIH Virus de l’immunodéficience humaine. En anglais : HIV (Human Immunodeficiency Virus). Isolé en 1983 à l’institut pasteur de paris; découverte récemment (2008) récompensée par le prix Nobel de médecine décerné à Luc montagnier et à Françoise Barré-Sinoussi.
- 7,6% présentent une immunosuppression importante (CD4 < 200/mm³)
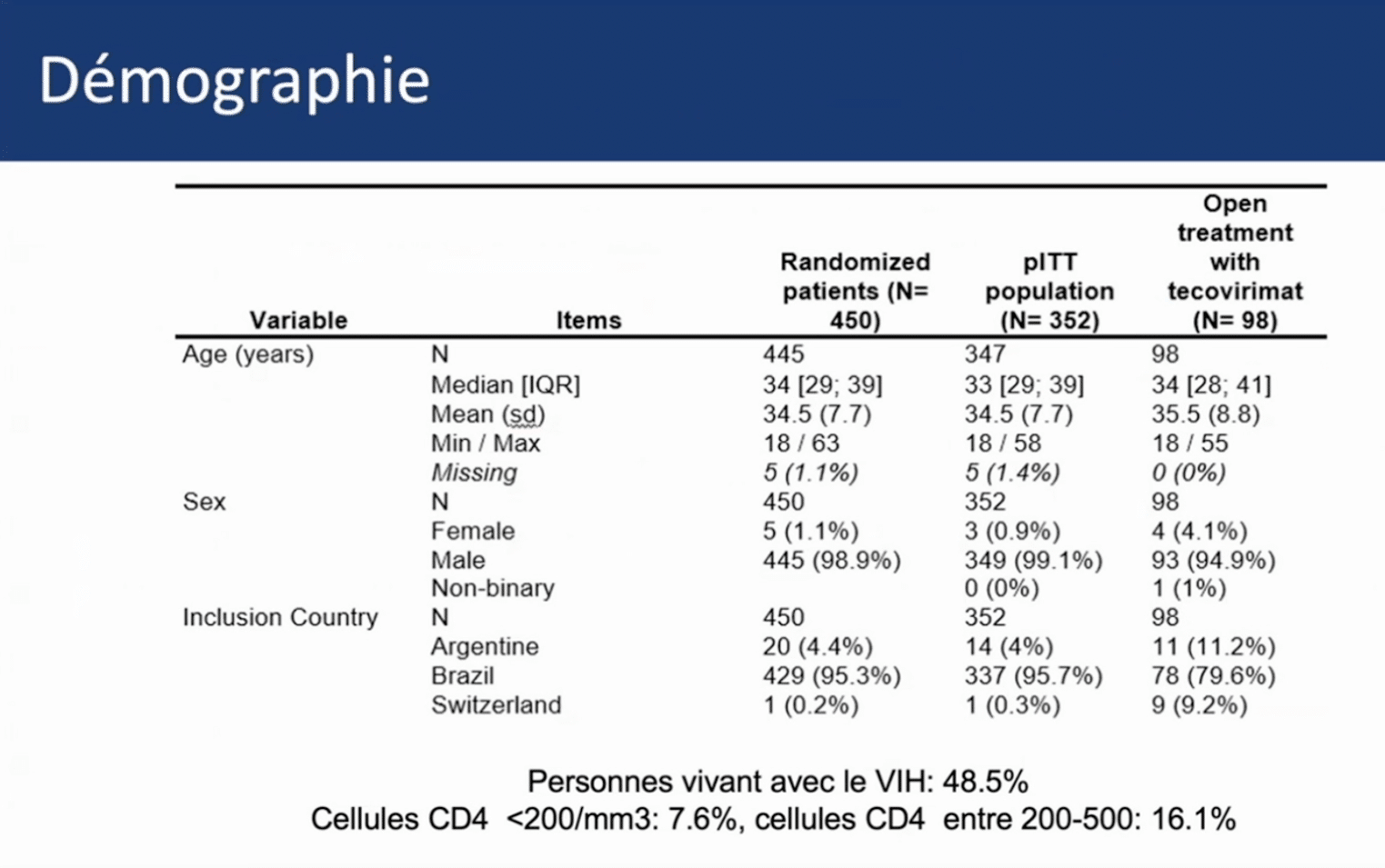
Ce taux élevé de personnes vivant avec le VIH correspond aux données épidémiologiques mondiales rapportées par l’OMS, qui indiquaient que près de 50% des personnes atteintes de mpox dans le monde vivaient avec le VIH, particulièrement avec la souche 2B qui s’est propagée en Europe et en Amérique.
Et c’est d’ailleurs l’une des principales explications avancées par l’équipe pour poursuivre l’essai : les différences marquées avec les populations étudiées par les essais précédents, tels que l’essai PAM007.
L’essai PAM007 en RDC
Placide Mbala Kingebeni, responsable du centre de recherche clinique et du laboratoire à l’Institut national de recherche biomédicale en RDC, est venu présenter les résultats ayant mené à l’arrêt de cette étude en attendant leur publication prochaine dans le New England Journal of Medicine.
L’étude PAM007, initiée en 2021 face à l’absence de traitement efficace contre le mpox, et démarrée en octobre 2022, comparait de manière randomisée le tecovirimat à un placebo en République démocratique du Congo (RDC). L’étude s’est déroulée sur deux sites en RDC : à Kole, dans le Sankuru, une région endémique pour le mpox depuis plus de 40 ans, et à Tunda, un site épidémique ayant connu une importante flambée entre novembre et décembre 2021. Au total, 597 participants ont été inclus dans l’étude PAM007 (313 à Tunda, 284 à Kole). La majorité des patients étaient âgés de moins de 18 ans et présentaient un nombre important de lésions, davantage que dans les études portant sur la souche 2. Parmi les personnes incluses, très peu étaient séropositives au VIH.
Les résultats furent malheureusement décevants :
- Aucune différence significative n’a été observée entre le tecovirimat et le placebo concernant la résolution des lésions;
- Aucune différence n’a été constatée en termes de mortalité ou d’effet sur la grossesse;
- Un léger effet thérapeutique a été observé à Kole mais pas à Tunda.
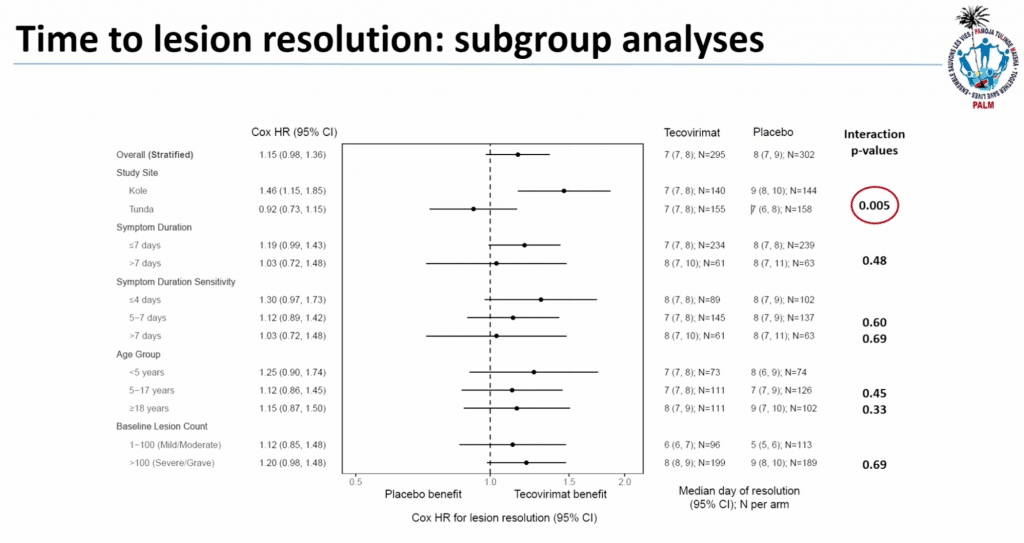
Des analyses de pharmacocinétique ont montré que la concentration moyenne du médicament était plus élevée chez les participants de Tunda que chez ceux de Kole. Environ 36% des participants avaient une concentration en dessous de 169 ng/mL (soit quatre fois la dose thérapeutique), mais aucune différence significative n’a été observée dans la résolution des lésions entre les patients ayant une concentration faible et ceux ayant une concentration élevée.
En décembre 2024, c’est l’équipe de l’essai STOMP du NIH qui a, à son tour, tiré des conclusions similaires.
Une décision collégiale et réfléchie
Face à ces résultats, la décision de poursuivre l’essai Unity n’a pas été prise à la légère selon Alexandra Calmy, et résulte de longues discussions avec le DSMB (le comité indépendant de surveillance des données), le Conseil scientifique, les investigateurs principaux et l’ANRS-MIE, en particulier son directeur Yazdan Yazdanpanah.
Plusieurs facteurs ont pesé dans la balance :
- Les différences entre les populations étudiées dans les trois essais ;
- Le profil de sécurité favorable du médicament : la molécule n’a pas montré d’effet indésirable sévère ;
- L’absence d’alternatives thérapeutiques ;
- La proximité de l’achèvement de l’étude.
Le Dr. Calmy a souligné l’importance de réaliser des essais cliniques rigoureux avant de conclure à l’efficacité d’un traitement, et a rappelé qu’aucun traitement antiviral ne dispose actuellement d’un haut niveau de preuves pour traiter le mpox, une maladie longtemps négligée jusqu’à son émergence sur la scène internationale en 2022.
L’historique de ces recherches autour du tecovirimat illustre l’importance cruciale de mener et de bénéficier des résultats d’essais cliniques rigoureux. Comme l’a rappelé Yazdan Yazdanpanah, «c’est une molécule qu’on a utilisée pendant trois ans en pensant qu’elle était très efficace». Les résultats de Unity, seront donc déterminants pour décider de l’avenir de cette molécule et, plus largement, pour orienter les futures recherches sur les traitements contre la mpox.
À ce jour, aucun traitement antiviral dont l’efficacité aurait été prouvé n’est actuellement disponible pour traiter l’infection par le mpox. Longuement négligée jusqu’à son émergence en Europe et en Amérique en 2022 dans des populations d’hommes ayant des rapports sexuels avec d’autres hommes (HSH), cette infection continue de sévir de façon persistante dans plusieurs régions du monde.

