Mise à jour : 29 janvier 2026.
Selon l’OMS, la moitié de la population mondiale est exposée au risque de dengue, et près de 400 millions d’infections surviennent chaque année, principalement dans les zones urbaines et semi-urbaines. De nombreuses infections à DENV sont asymptomatiques ou ne s’accompagnent que de manifestations bénignes, mais il existe des formes sévères susceptibles d’entraîner la mort.
Description
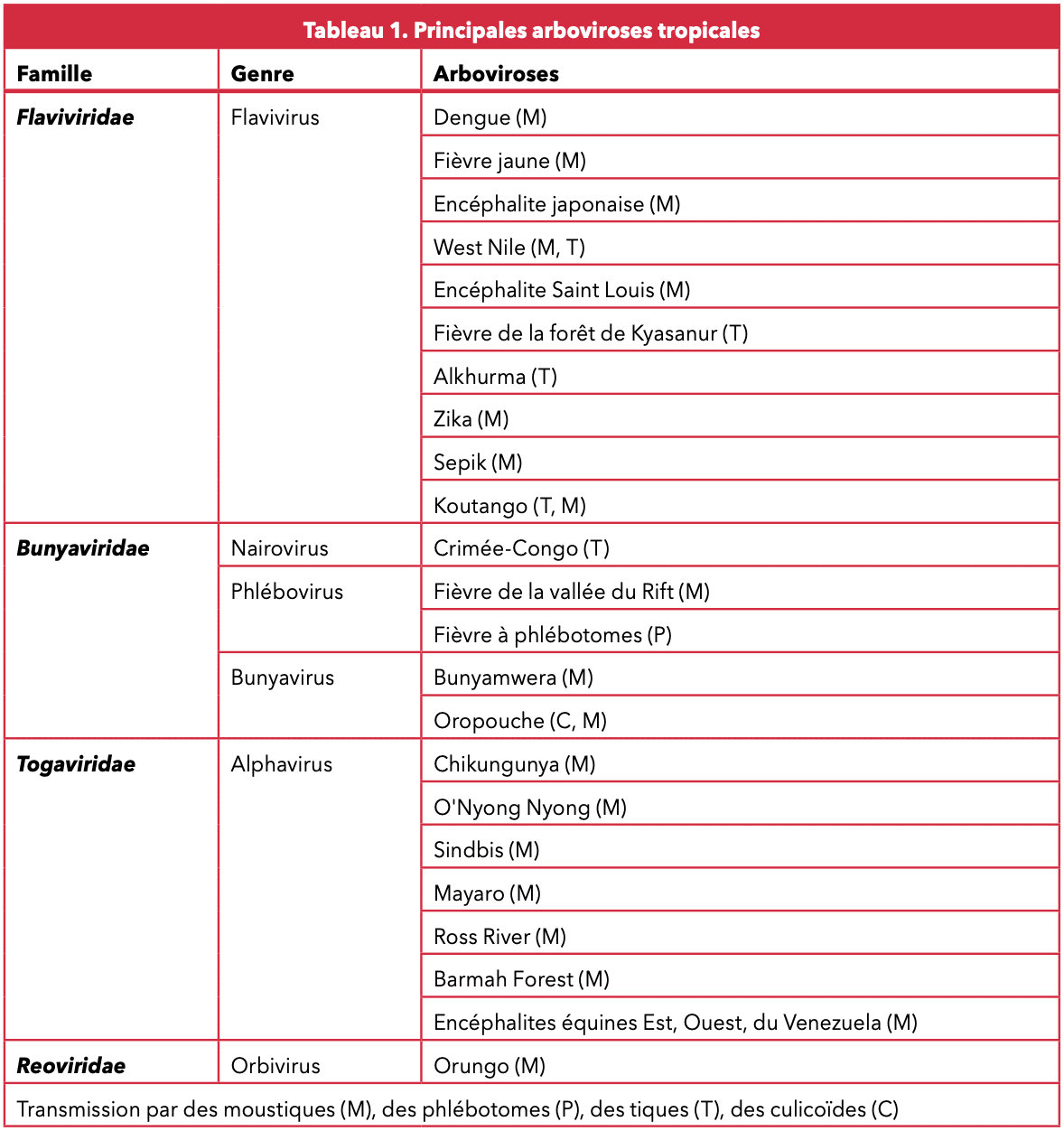
La dengue est une maladie infectieuse due à un arbovirusArbovirose Les arboviroses sont des maladies virales dues à des arbovirus transmis obligatoirement par un vecteur arthropode (moustique, moucheron piqueur, tique) à des hôtes vertébrés (mammifères, oiseaux), d’où leur nom adapté de l’anglais : ARthropod-BOrne virus. (virus transmis par les arthropodes) appartenant à la famille des Flaviridae comme le West Nile ou le virus de la fièvre jaune. C’est donc une arboviroseArbovirose Les arboviroses sont des maladies virales dues à des arbovirus transmis obligatoirement par un vecteur arthropode (moustique, moucheron piqueur, tique) à des hôtes vertébrés (mammifères, oiseaux), d’où leur nom adapté de l’anglais : ARthropod-BOrne virus. et également, une zoonose puisque transmise de l’animal à l’homme. Il existe quatre sérotypes : DENV-1, DENV-2, DENV-3 et DENV-4. L’immunité acquise en réponse à l’infection par l’un des sérotypes confère une immunité protectrice contre le sérotype infectant, mais pas contre les autres. En théorie, un individu est donc susceptible d’être infecté par chacun des quatre sérotypes de la dengue. C’est une maladie à déclaration obligatoire.
La transmission du virus à l’Homme se fait par une piqûre de moustique femelle infectée, appartenant principalement aux espèces du genre Aedes – Aedes aegypti et Aedes albopictus (le fameux moustique tigre).
Épidémiologie
La maladie est aujourd’hui endémique dans plus de 100 pays, notamment en Afrique, dans les Amériques, dans les régions de la Méditerranée orientale, de l’Asie du Sud-Est et du Pacifique occidental. Avec plus de 14,6 millions de cas de dengue, dont plus de 12 000 mortels, signalés en 2024, un pic historique a été atteint.
Le réchauffement climatique, l’urbanisation rapide et la mobilité internationale offrent aux moustiques Aedes de nouveaux territoires de colonisation, y compris dans des zones tempérées (lire notre article : Du sud au nord : comment le moustique tigre redessine la carte des épidémies). La dengue se propage ainsi à de nouvelles zones géographiques jusque-là épargnées. Des flambées épidémiques explosives ont été observées en Europe et une transmission locale a été signalée pour la première fois dans l’Hexagone et en Croatie en 2010. En 2012, une flambée sur l’archipel de Madère a provoqué plus de 2000 cas et des cas importés ont été détectés dans 10 autres pays européens.
En 2013, l’épidémie a été déclarée en Guyane. La même année, 2,35 millions de cas ont été signalés dans la région des Amériques, dont 37 687 de forme sévère.
Entre 2010 et 2022, 114 cas autochtones ont été recensés en France hexagonale. Début 2025, le moustique vecteur est implanté dans 81 départements français. Entre le 1er janvier et le 12 août 2025, 11 cas de transmissions locales et 746 cas importés en France métropolitaine ont été rapportés.
En 2024, 308 cas ont été notifiés à l’OMS par trois pays européens (l’Espagne, la France et l’Italie) et 1 291 cas supplémentaires, dont quatre mortels, ont été enregistrés dans les départements français d’outre-mer de Mayotte et de la Réunion.
De janvier à juillet 2025, plus de 4 millions de cas, dont plus de 3 000 mortels, ont été notifiés à l’OMS par 97 pays.
Symptômes
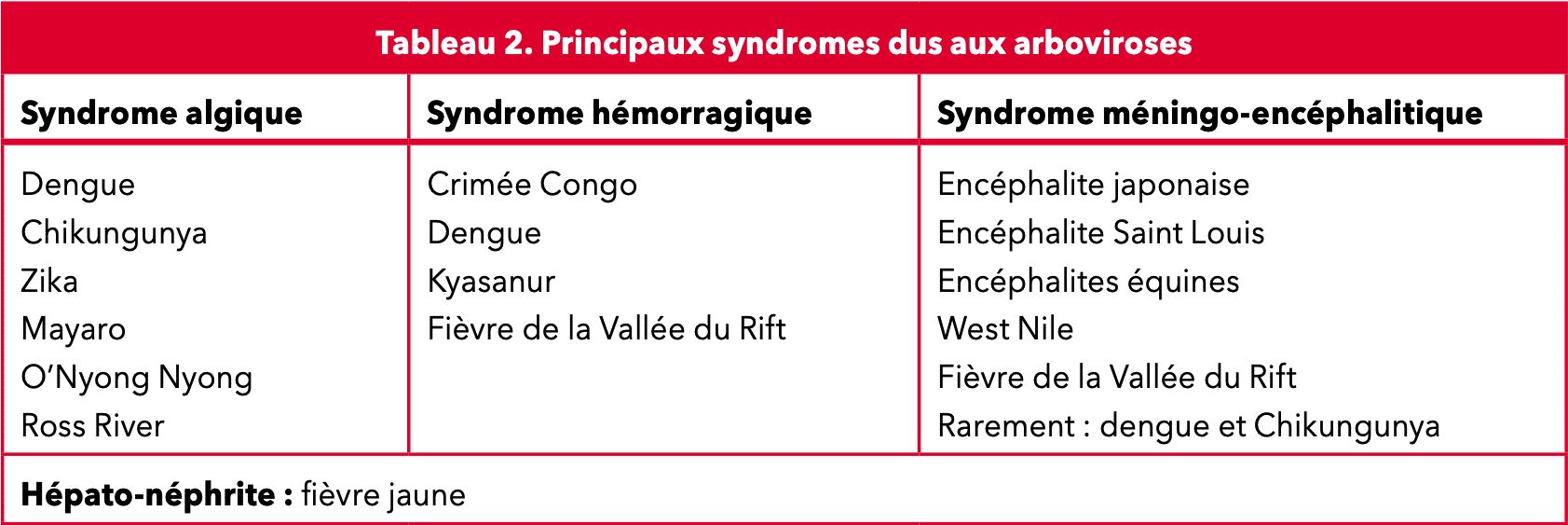
La plupart des malades ne présentent pas de symptômes ; les cas symptomatiques débutent généralement par une forte fièvre, qui s’accompagne rapidement de maux de tête, de douleurs musculaires et articulaires, de nausées et vomissements, et éventuellement d’une éruption cutanée. Ces symptômes apparaissent habituellement 4 à 10 jours après l’infection et durent le plus souvent entre 2 et 7 jours.
Dans moins de 5% des cas, la maladie évolue vers une forme sévère (dengue hémorragique), notamment chez les personnes infectées pour la deuxième fois, pouvant mettre en jeu le pronostic vital. La grossesse ou certaines pathologies chroniques peuvent aussi augmenter le risque de forme sévère : notamment l’immunodépression ou des maladies chroniques (drépanocytose, diabète, hypertension artérielle compliquée, insuffisance rénale, affections cardio-pulmonaires chroniques, etc.).
La persistance et l’aggravation des symptômes initiaux (douleurs abdominales, vomissements, fatigue), et l’apparition de nouveaux signes (saignement des gencives ou du nez, troubles de la conscience, toux), après la disparition de la fièvre, doivent alerter. C’est pourquoi Santé publique France conseille d’être particulièrement vigilant autour du 4e jour. Les patients concernés doivent recevoir des soins immédiatement.
La gravité de la maladie dépend du terrain, de l’âge et du sérotype du virus infectieux : le sérotype 2 (DENV-2) serait plus susceptible de provoquer des cas graves et il semblerait que les infections successives favorisent le risque de développer une dengue hémorragique.
Les conséquences post-infectieuses sont bien décrites : myalgies (douleurs musculaires), fièvre, sueurs, céphalées, faiblesse/asthénie, avec une fréquence de 8,5 % à 6 mois, diminuant avec le temps, et une perte de productivité importante.
Dans une étude datant de 2019, le fardeau annuel de la dengue était évalué à 1,1 / 2,9 millions DALY (Disability adjusted life year), dont 45,9 / 32,6% d’années perdues en bonne santé à cause des conséquences post infectieuses1TM. Hung et al. Trends Parasitol. 2019 Sep;35(9):673-676.
Traitement et prévention
Il n’existe actuellement aucun traitement curatif de la dengue ; le seul traitement est symptomatique, il comprend du repos, une hydratation régulière et des antalgiques à base de paracétamol (éviter l’aspirine et les anti-inflammatoires non stéroïdiens qui augmentent le risque de saignement) peuvent soulager les symptômes et prévenir les complications. Les cas de dengue sévère, quant à eux, nécessitent d’être pris en charge à l’hôpital, notamment en unité de soins critiques.
L’enjeu pour lutter contre cette arbovirose repose sur la prévention ; celle-ci consiste principalement à détruire les moustiques vecteurs en éliminant leurs habitats de reproduction (eau stagnante, gouttières, seaux, détritus…) et à se protéger des piqûres à l’aide de répulsifs (sprays, crèmes, vêtements longs…) et de moustiquaires.
Un modèle complexe de réponse immunitaire
La réponse immunitaire contre la dengue est un modèle complexe souvent pris comme exemple et qui mérite quelques explications : lors d’une infection par un autre sérotype du DENV, les lymphocytes T mémoires à réaction croisée, et à forte avidité antigénique, peuvent être réactivés. L’activité antivirale de ces lymphocytes T à réaction croisée est très faible mais ils produisent des cytokines pro-inflammatoires de manière excessive : c’est la tempête cytokinique (comme en cas de Covid), caractéristique de la fièvre hémorragique, traduisant une réponse immunitaire non-spécifique, inefficace dans l’élimination du virus, et extrêmement délétère pour la personne infectée. D’autre part, la réponse anticorps lors d’une réinfection peut être paradoxalement “facilitante”. Si les anticorps permettent la neutralisation des virions libres, l’élimination des cellules infectées et l’induction de réponses immunitaires fortes, ils peuvent à l’inverse augmenter la pathogénicité associée au DENV dans le cas d’une infection secondaire par un sérotype viral différent. On parle alors d’aggravation dépendante des anticorps ou d’anticorps facilitants. Ces anticorps à réaction croisée produits à la suite de la première infection sont peu neutralisants, mais leur activation lors de la seconde infection favorise fortement la multiplication du DENV, avec un accroissement de la multiplication virale pouvant aller jusqu’à cent fois chez des macaques rhésus. Le mécanisme facilitant est une des raisons qui rend très difficile la mise au point de vaccins anti-DENV efficaces et bien tolérés, et qui justifie pour certaines autorités sanitaires le recueil de l’information d’une infection par le virus de la dengue préalable à la vaccination (cf infra).
Après la désillusion du premier vaccin contre la dengue, développé à partir d’une souche atténuée du virus de la fièvre jaune, et la polémique autour des décès d’enfants aux Philippines, un certain nombre de questions demeurent quant à la popluation à vacciner et aux politiques vaccinales à adopter qui diffèrent grandement d’un pays à l’autre.Il existe néanmoins un vaccin contre la dengue : le vaccin Qdenga® (Takeda), qui a obtenu une autorisation de mise sur le marché européenne en décembre 2022. En France, la Haute Autorité de santé (HAS) (décembre 2025) recommande la vaccination contre la dengue par le vaccin Qdenga® aux Antilles, en Guyane, à Mayotte et à La Réunion :
- Chez les enfants et adolescents âgés de 6 à 16 ans dont les parents ou tuteurs légaux sont dans la capacité de produire une preuve documentée d’une infection antérieure à la dengue, pour l’enfant/adolescent à vacciner. La preuve d’une infection antérieure de dengue peut être soit une confirmation biologique obtenue en laboratoire (RT-PCR, antigénémie NS1, sérologieSérologie Étude des sérums pour déterminer la présence d’anticorps dirigés contre des antigènes. IgM/IgG), soit une dengue cliniquement diagnostiquée en contexte épidémique et inscrite dans le carnet de santé de l’enfant ou de l’adolescent. En l’absence de preuve documentée d’infection antérieure de dengue, un test sérologique ELISA ou EIA réalisé en laboratoire pourra être effectué. La réalisation d’un dépistage pré-vaccinal de façon systématique n’est, cependant, pas recommandée.
- Chez les sujets âgés de 17 à 60 ans présentant des comorbidités (drépanocytose, hypertension artérielle compliquée, diabète, obésité, insuffisance rénale, affections cardio-pulmonaires chroniques, autres hémoglobinopathies, thrombocytopathies) avec ou sans antécédent de dengue, en raison du risque de décompensation de pathologies sous-jacentes.
La vaccination par Qdenga® peut être proposée au cas par cas aux enfants et adolescents drépanocytaires sans antécédent de dengue, âgés de 6 à 16 ans, résidant dans ces territoires, sous réserve d’une décision éclairée partagée entre le médecin, les centres de référence et de compétence de la drépanocytose et les parents, prise après une information des parents sur les bénéfices et les risques de la vaccination par Qdenga® dans cette population. Les personnes sans antécédent de dengue doivent être préalablement informées que le vaccin Qdenga® peut ne pas conférer de protection contre les sérotypes DENV-3 et DENV-4 et que les données actuellement disponibles ne permettent pas d’exclure un risque de forme sévère chez les personnes séronégatives vaccinées qui seraient ultérieurement exposées aux sérotypes DENV-3 et DENV-4.
L’efficacité de ce vaccin varie selon les groupes d’âge, les sérotypes (69 % contre DENV-1 ; 90,8 % contre DENV-2 ; 51,4 % contre DENV-3 et 50 % contre DENV-4) et le statut sérologique initial (74 ,8 % pour les personnes ayant déjà été infectées et 67 % chez celles ne l’ayant jamais été). L’efficacité globale est autour de 95 % sur les formes sévères de dengues.
Le vaccin Dengvaxia® (Sanofi Pasteur) n’est plus commercialisé depuis le mars 2024. Plusieurs autres vaccins candidats contre la dengue sont en cours d’évaluation et de développement.
Bibliographie
- Sources :OMS,Santé publique France,Institut Pasteur,Vaccination info service,ANRS
- Vaccination contre la dengue : la HAS publie ses recommandations
- Govindaraj Anumanthan 1, Bikash Sahay 1, Ayalew Mergia 1Current Dengue Virus Vaccine Developments and Future Directions, Viruses 2025 Jan 31;17(2):212. doi: 10.3390/v17020212.
- Le calendrier des vaccinations
Première version de la page : Christelle Destombes, 11 juillet 2023
M.A.J. : Amélie Pelletier, Gilles Pialoux, le 29 janvier 2026.
