D’après Gaur AH et al., abstr. 738 et Lowenthal ED et al., abstr. 739, actualisés.
Ont été présentées à la CROICROI «Conference on Retroviruses and Opportunistic Infections», la Conférence sur les rétrovirus et les infections opportunistes annuelle où sont présentés les dernières et plus importantes décision scientifiques dans le champs de la recherche sur le VIH. 2022 les données à ce jour de la cohorte 1, Q4W, de l’étude (abstr. 738). Les adolescents virologiquement supprimés (charge virale < 50 copies/mL) vivant avec le VIH-1 et sous traitement antirétroviral combiné stable (cART) ont été recrutés dans la cohorte 1C (CAB) ou la cohorte 1R (RPV) en fonction du cARTcART Combination antiretroviral therapy (cART) ou traitement antirétroviral combiné, en français. Le terme est utilisé quand il est important de préciser qu'il s'agit d'une multithérapie basée sur plusieurs antirétroviraux, et non d'une monothérapie. de base. Après 4 semaines d’initiation par voie orale avec CAB (30 mg ×1/j) ou RPV (25 mg ×1/j), les participants ont reçu CAB-LA (600 mg/3mL à S4 et 400 mg/2mL à S8 et S12) ou RPV-LA (900 mg/3mL à S4 et 600 mg/2mL à S8 et S12) par injection intramusculaire. Le traitement antirétroviral de fond a été maintenu tout au long de la cohorte 1. Des échantillons pharmacocinétiques ont été prélevés à S2 (pour évaluer la posologie orale) et à S4, S5, S6, S8, S12, S13, S14 et S16 (pour évaluer la posologie LA). Au moment de cette analyse, 23 participants ont été inclus, avec 2 arrêts prématurés du traitement à l’étude, tous 2 dans la cohorte 1R ; l’un en raison d’une hypersensibilité (après la 1re dose orale) et l’autre en raison d’une douleur à l’insertion de l’aiguille avant la 1re injection intramusculaire. La cohorte 1C comprenait 6 hommes et 2 femmes d’âge médian de 14,5 (12-17) ans et pesant en moyenne 57 (43-73,5) kg ; la cohorte 1R comprenait 7 hommes et 8 femmes d’âge médian de 17,0 (12-17) ans et pesant en moyenne 63 (44,1-98,5) kg. Toutes les réactions au site d’injection étaient de grade 1 ou 2 et aucune n’a conduit à l’arrêt du traitement. Jusqu’à S16, il y a eu un événement indésirable de grade 3 lié au médicament dans chaque cohorte (insomnie, 1C et hypersensibilité, 1R, menant à l’abandon de l’étude). Les paramètres pharmacocinétiques médians se situaient dans les cibles souhaitées de l’étude, sur la base de l’obtention d’une exposition comparable chez les adolescents et les adultes (figure) :
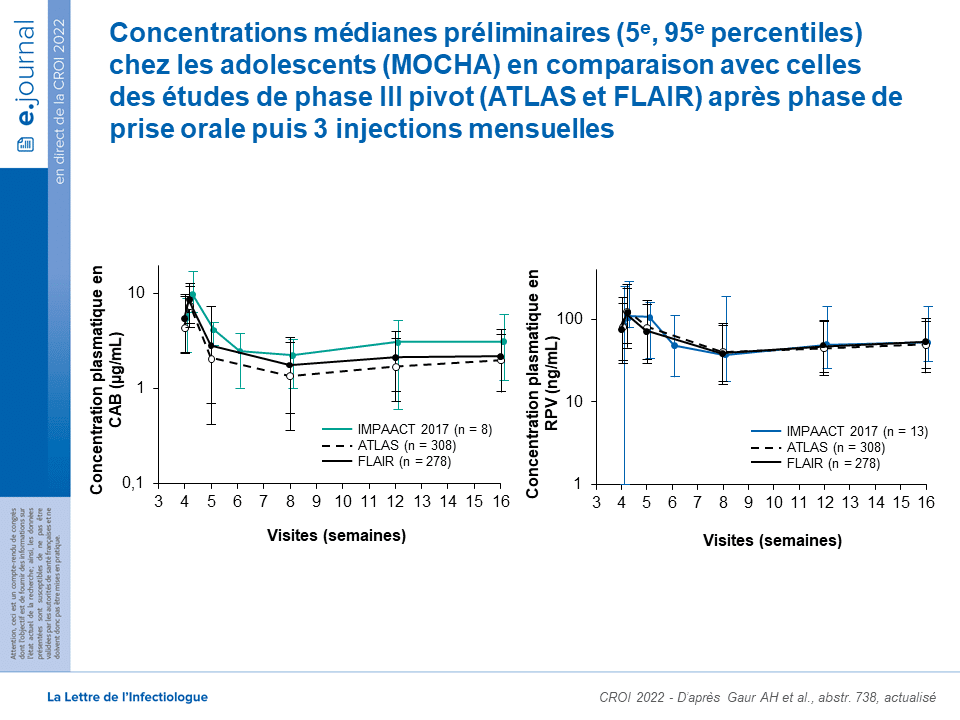
- Cohorte 1C à S2, CAB oral ASC0-τ : 160 (94,3-325) mcg*h/mL (médiane cible 46-277), à S16 concentration cible de CAB i.m. : 3,11 (1,22-6,19) mcg/mL (médiane cible 0,71-6,7).
- Cohorte 1R à S16, concentration cible de RPV IM : 52,9 (31,9-148) ng/mL (médiane cible 25-100).
En conclusion, l’administration par voie intramusculaire de CAB-LA ou de RPV-LA chez les adolescents a permis d’atteindre des concentrations d’exposition cibles conformes aux prévisions et comparables à celles des adultes recevant des injections i.m. mensuelles. Aucun signal de sécurité nouveau ou imprévu n’a été identifié.
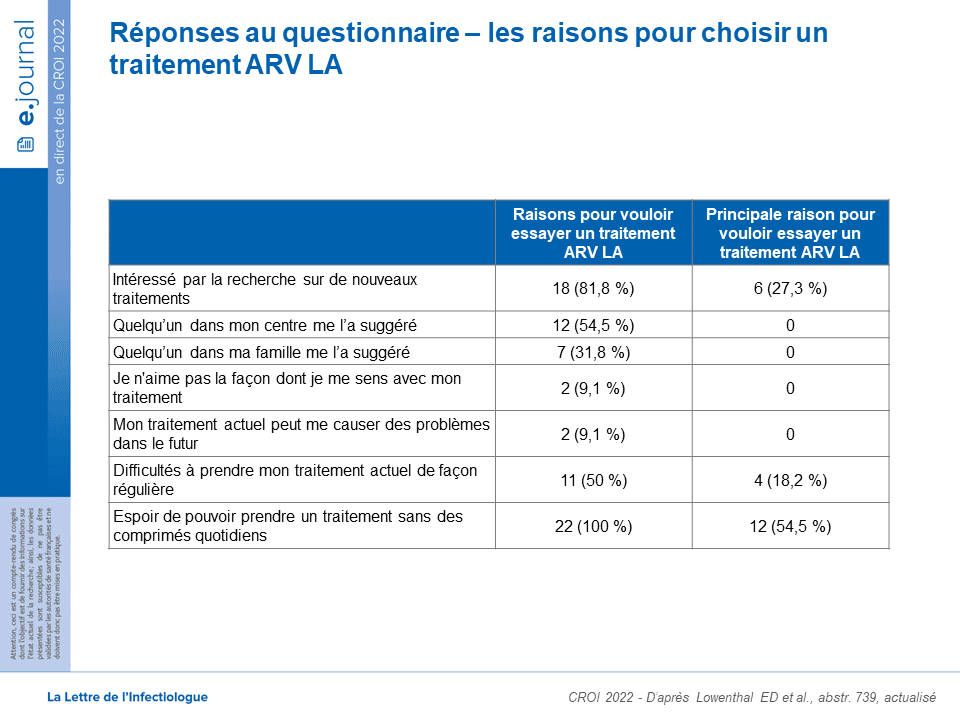
Dans la même session, un poster (abstr. 739) rapporte les perceptions des adolescents et des parents interrogés dans le cadre de cette étude : les perceptions sont globalement favorables (tableau), avec une qualité de vie comparable. Sur 21 adolescents ayant reçu 3 injections, 90,5 % (19/21) déclarent vouloir continuer à recevoir un traitement ARV LA, y compris après la fin de l’étude (71,4 % de façon définitive, 19,1 % probablement).
Cet article a été publié initialement dans le e-journal de « La Lettre de l’infectiologue » couvrant la conférence, nous le reproduisons ici avec leur aimable autorisation.
