Alors que l’Afrique centrale fait face à une flambée de mpox (anciennement variole du singe), la République démocratique du Congo (RDC) a lancé en septembre 2025 une vaste campagne de vaccination avec le vaccin LC16m8, soutenue par le gouvernement japonais et la CEPI (Coalition for Epidemic Preparedness Innovations). Trois millions de doses ont été offertes à la RDC, qui sera ainsi le premier pays africain à collecter des données de terrain essentielles sur l’efficacité de ce vaccin dans un contexte épidémique.
Un vieux nouveau vaccin
Contrairement à ce que son usage récent contre le mpox pourrait laisser penser, le LC16m8 n’est pas une innovation de dernière génération1.
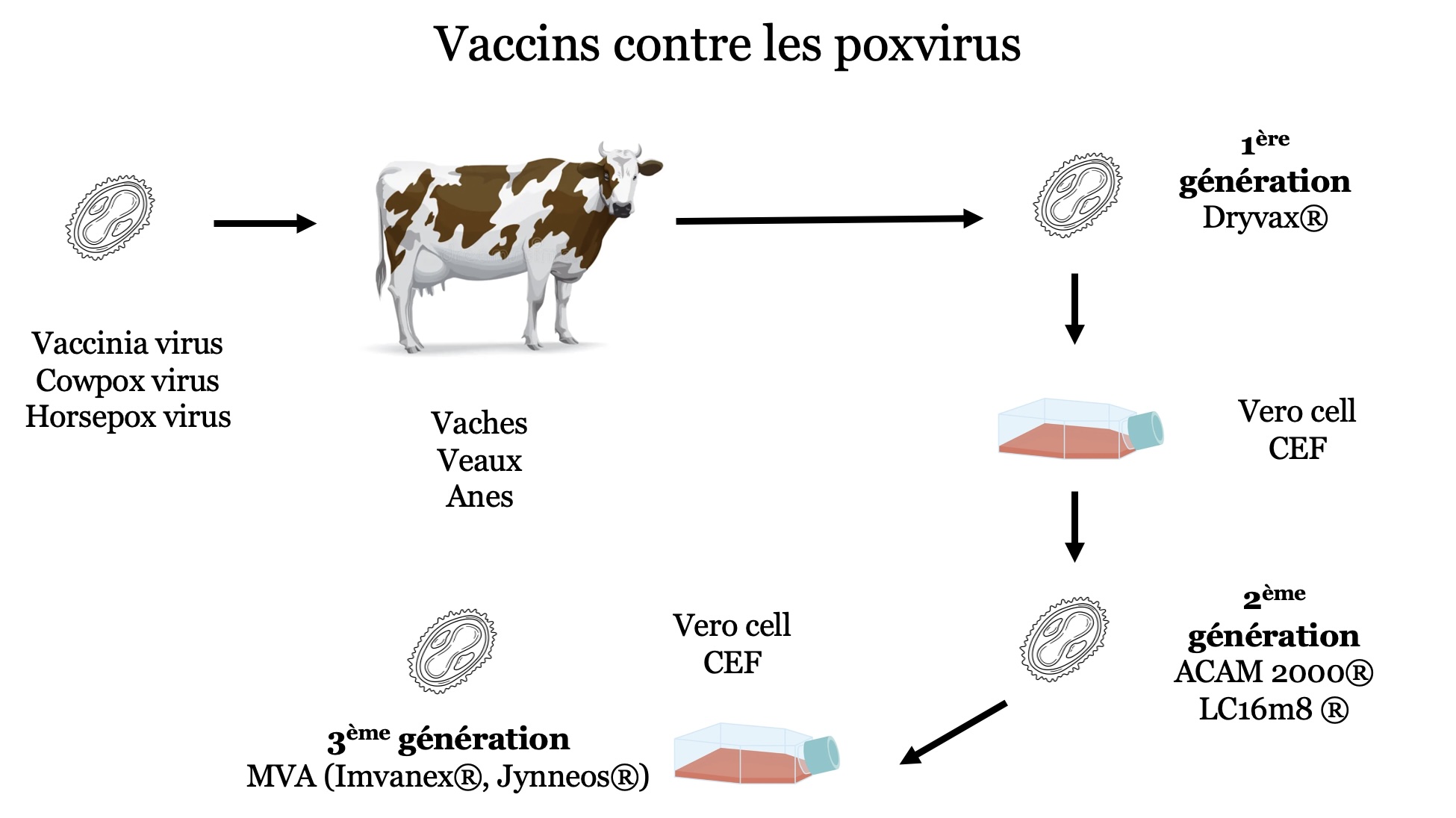
Développé au Japon dans les années 1970 par le Chiba Serum Institute, il s’agit d’un vaccin vivant atténué dérivé de la souche Lister de la vaccine. Il a été licencié en 1980 au Japon, puis confié à KAKETSUKEN (aujourd’hui KM Biologics) pour sa production en 2003. Comme le vaccin MVA-BN (Imvanex/Jynneos), il s’agit d’un vaccin vivant atténué, mais contrairement à dernier, c’est un vaccin réplicatif, ce qui lui permet de conférer une immunité robuste après une seule dose, qui doit toutefois être administrée ici par scarification.
Lors de son introduction au Japon, le LC16m8 a été administré à plus de 50000 enfants. Les résultats publiés montrent un excellent profil de tolérance : taux de « prise » (réaction cutanée locale marqueur de l’efficacité) supérieur à 95%, peu de fièvre, aucune encéphalite recensée, et un seul cas d’eczema vaccinatum rapporté2. Plus récemment, des études menées au Japon et aux États-Unis ont confirmé son immunogénicitéImmunogénicité Capacité à produire une réponse immunitaire. et l’absence de myocardite ou d’encéphalite, effets indésirables parfois redoutés avec les anciens vaccins antivarioliques.
Un atout dans la lutte contre le mpox… mais avec des limites
L’efficacité croisée des vaccins antivarioliques contre le mpox est bien documentée, et le LC16m8 n’y fait pas exception avec cependant pour l’instant des données de protection uniquement chez l’animal. S’il protège les primates non humains dans des modèles d’infection létale3 —avec une protection persistant au moins 6 mois4 —, les données disponibles chez l’homme sont uniquement immunologiques avec l’induction d’anticorps neutralisants dont on connait le pouvoir protecteur5. En Afrique, où les flambées de cladeClade Les clades désignent les variations d’un même virus qui ont divergé au gré des mutations génétiques. I sont particulièrement sévères, l’arrivée d’un vaccin sûr et efficace en dose unique est une avancée majeure. Cependant, son caractère réplicatif peut poser des limites. Les recommandations japonaises indiquent que les personnes immunodéprimées ou sous traitement immunosuppresseur, les femmes enceintes ainsi que les patients atteints de certaines affections dermatologiques (eczéma notamment) ne doivent pas recevoir le vaccin LC16m8.
Les contre-indications chez les sujets immunodéprimés sont toutefois à moduler. Contrairement à ce qui se produit avec des vaccins plus anciens (Dryvax), la déplétion des lymphocytes B ou T n’induit pas de vaccine généralisée après vaccination avec le LC16m8 chez le primate non humain6. Par ailleurs, une étude récente montre la bonne tolérance et la bonne immunogénicité du vaccin chez les personnes vivant avec le VIHVIH Virus de l’immunodéficience humaine. En anglais : HIV (Human Immunodeficiency Virus). Isolé en 1983 à l’institut pasteur de paris; découverte récemment (2008) récompensée par le prix Nobel de médecine décerné à Luc montagnier et à Françoise Barré-Sinoussi. (PVVIH) à la réserve qu’il s’agissait de sujets sous traitement antirétroviral depuis plus de 6 mois avec un taux de lymphocytes T CD4 > 200/mm37. Pour une pathologie pour laquelle l’infection VIH représente un facteur de risque et dans un pays où la cascade de soin n’est pas optimale, cette restriction est loin d’être négligeable, et impose de réfléchir à des stratégies différenciées de vaccination.
NCT07093489, Une étude pour observer la protection et la sécurité du vaccin
L’étude observationnelle lancée en République démocratique du Congo (NCT07093489) représente une étape essentielle pour mieux comprendre l’efficacité et la tolérance du vaccin LC16m8 en conditions réelles d’épidémie. Conçue pour suivre de près l’impact du vaccin dans des zones où la transmission du mpox est élevée, elle inclut notamment les nourrissons et les enfants dès l’âge d’un an, une population jusqu’ici peu documentée dans les études cliniques.
Les données attendues permettront d’évaluer non seulement la protection conférée contre les formes graves de la maladie, mais aussi le profil de sécurité du vaccin dans un contexte africain, où les comorbidités, les co-infections et les réalités sanitaires diffèrent sensiblement de celles observées au Japon ou en Europe.
Vers un portefeuille vaccinal diversifié pour anticiper les épidémies de demain
La disponibilité du LC16m8 vient compléter utilement l’arsenal vaccinal contre le mpox, jusque-là largement dominé par le MVA-BN (Imvanex/Jynneos). Ces deux vaccins ont chacun leurs avantages et leurs inconvénients: sécurité d’utilisation démontrée y compris chez les personnes immunodéprimées pour le MVA-BN mais avec une efficacité dépendant du respect du schéma vaccinal complet à 2 doses ; immunité robuste après une seule dose et recul considérable, notamment chez l’enfant pour le LC16m8, mais utilisation contre-indiquée chez les personnes immunodéprimées dont possiblement les PVVIHPVVIH Personne vivant avec le VIH non traitées
Dans le contexte des flambées actuelles de mpox, en particulier en Afrique centrale où la circulation du clade I s’accompagne d’une mortalité importante, le défi est double : garantir une couverture vaccinale suffisante et adapter les stratégies aux populations les plus vulnérables. Les campagnes en cours, avec des millions de doses disponibles de LC16m8 offertes par le Japon, témoignent d’un engagement international fort, mais elles ne suffiront probablement pas à elles seules à enrayer durablement l’épidémie.
Au-delà de l’urgence immédiate, la situation actuelle souligne la nécessité d’anticiper. Si les vaccins antivarioliques historiques comme le MVA-BN et le LC16m8 démontrent une efficacité protectrice, leur conception repose sur des technologies anciennes, peu flexibles face aux évolutions épidémiologiques et aux besoins différenciés des populations. C’est pourquoi l’exploration de nouvelles plateformes, en particulier les vaccins à ARN messager, apparaît comme une priorité stratégique8. Face à des maladies réémergentes ou émergentes, il est indispensable de disposer d’un portefeuille diversifié de vaccins, avec de nouvelles plateformes plus rapides à développer et mieux adaptées aux contraintes sanitaires contemporaines. L’épidémie actuelle de mpox devrait être l’occasion de bâtir cette stratégie globale, afin de transformer une crise en levier pour renforcer durablement la préparation vaccinale mondiale.
L’initiative CEPI
La Coalition for Epidemic Preparedness Innovations (CEPI), ou Coalition pour les innovations en matière de préparation aux épidémies en français, a pour but d’améliorer la préparation des gouvernements mondiaux face aux futures menaces épidémiques et pandémiques. Cette initiative a été lancée à Davos en 2017 par les gouvernements norvégien et indien, la Fondation Bill & Melinda Gates, Wellcome et le Forum économique mondial. Sa stratégie 2022-2026 —baptisée CEPI 2.0— vise à mettre en œuvre sa Mission des 100 jours : favoriser le développement de vaccins sûrs, efficaces et accessibles en moins de trois mois.
Avec le soutien financier de plus de 30 gouvernements, fondations philanthropiques et sociétés, la CEPI a investi à ce jour dans plus de 70 candidats vaccins (ou plateformes technologiques) ciblant ces agents pathogènes prioritaires : le Chikungunya, Ebola, la fièvre de Lassa, le MERS, le virus Nipah, la fièvre de la vallée du Rift et bien sûr le Covid-19Covid-19 Une maladie à coronavirus, parfois désignée covid (d'après l'acronyme anglais de coronavirus disease) est une maladie causée par un coronavirus (CoV). L'expression peut faire référence aux maladies suivantes : le syndrome respiratoire aigu sévère (SRAS) causé par le virus SARS-CoV, le syndrome respiratoire du Moyen-Orient (MERS) causé par le virus MERS-CoV, la maladie à coronavirus 2019 (Covid-19) causée par le virus SARS-CoV-2. La CEPI a d’ailleurs été parmi les premiers bailleurs de fonds pour les vaccins face à ce dernier. Elle a également cofondé COVAX, une initiative qui a permis de livrer près de deux milliards de doses de vaccins à 146 pays, sauvant ainsi une estimation d’environ 2,7 millions de vies dans les pays à faible revenu éligibles aux doses gratuites.
En investissant dès maintenant dans la recherche contre des menaces connues, la CEPI cherche à réduire le risque de pandémies qui pourraient être causées par une future « maladie X » encore inconnue.
Références
- Kenner J, Cameron F, Empig C, Jobes DV, Gurwith M. LC16m8: An attenuated smallpox vaccine. Vaccine. nov 2006;24(47‑48):7009‑22. ↩︎
- Grabenstein JD, Hacker A. Vaccines against mpox: MVA-BN and LC16m8. Expert Review of Vaccines. 31 déc 2024;23(1):796‑811. ↩︎
- Saijo M, Ami Y, Suzaki Y, Nagata N, Iwata N, Hasegawa H, et al. LC16m8, a Highly Attenuated Vaccinia Virus Vaccine Lacking Expression of the Membrane Protein B5R, Protects Monkeys from Monkeypox. J Virol. juin 2006;80(11):5179‑88. ↩︎
- Iizuka I, Ami Y, Suzaki Y, Nagata N, Fukushi S, Ogata M, et al. A Single Vaccination of Nonhuman Primates with Highly Attenuated Smallpox Vaccine, LC16m8, Provides Long-term Protection against Monkeypox. Jpn J Infect Dis. 2017;70(4):408‑15. ↩︎
- Morino E, Mine S, Tomita N, Uemura Y, Shimizu Y, Saito S, et al. Mpox Neutralizing Antibody Response to LC16m8 Vaccine in Healthy Adults. NEJM Evidence [Internet]. 27 févr 2024 [cité 13 sept 2025];3(3). Disponible sur: https://evidence.nejm.org/doi/10.1056/EVIDoa2300290 ↩︎
- Gordon SN, Cecchinato V, Andresen V, Heraud JM, Hryniewicz A, Parks RW, et al. Smallpox Vaccine Safety Is Dependent on T Cells and Not B Cells. The Journal of Infectious Diseases. 15 avr 2011;203(8):1043‑53. ↩︎
- Okumura N, Morino E, Nomoto H, Yanagi M, Takahashi K, Iwasaki H, et al. LC16m8 for Pre-exposure Prophylaxis Against Mpox in a High-Risk Population: An Open-Label Randomized Trial. Clinical Infectious Diseases. 21 févr 2025;ciaf074. ↩︎
- Mucker EM, Freyn AW, Bixler SL, Cizmeci D, Atyeo C, Earl PL, et al. Comparison of protection against mpox following mRNA or modified vaccinia Ankara vaccination in nonhuman primates. Cell. oct 2024;187(20):5540-5553.e10. ↩︎
