D’après Young I et al., abstr. 80, actualisé
Cette équipe (Chapel-Hill, Etats-Unis) propose de développer un implant injectable à action prolongée, biodégradable et amovible (ISFI) en tant que technologie de prévention polyvalente (MPT) pour la prévention du VIH et des grossesses non planifiées.
Les ISFI ont été générés en co-formulant du PLGA, de la NMP ou du DMSO et des API dans une solution ou une suspension stable. Les ISFI ont été remplis avec l’un des deux ARV, le dolutégravir (DTG) ou le cabotégravir (CAB), et l’un des deux contraceptifs, l’étonogestrel (ENG) ou l’acétate de médroxyprogestérone (MPA).
Une étude pharmacocinétique (PK) et d’innocuité de 90 jours a été menée chez des souris BALB/c femelles avec des formulations optimisées d’ISFI MPT. Les souris (n=12/groupe) ont reçu une injection sous-cutanée de 50 µL de formulations ISFI MPT. Des échantillons de plasma ont été collectés pour quantifier la concentration du médicament et les taux de TNF-α et d’IL-6. Aux jours 3, 7, 30 et 90, le dépôt et le tissu environnant ont été retirés pour une coloration H&E afin d’évaluer l’inflammation locale. Au jour 90, les dépôts ont été retirés pour quantifier le médicament résiduel, évaluer la dégradation du polymère par chromatographie par perméation de gel (CPG) et la microstructure du dépôt par MEB (microscopie électronique). Les concentrations plasmatiques in vivo de CAB et de DTG étaient bien supérieures à leur IC90 4× PA pendant 90 jours, ont démontré une cinétique de libération d’ordre zéro et n’ont montré aucune différence dans la libération du médicament lorsqu’ils étaient formulés avec l’une ou l’autre hormone (figure ci-dessous).
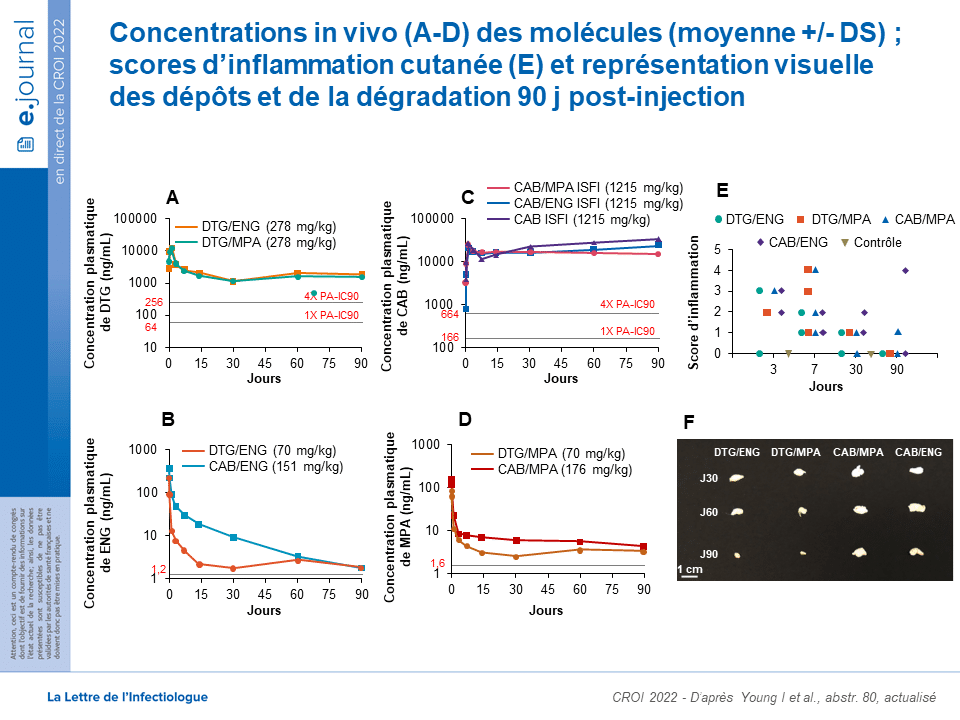
En outre, les concentrations plasmatiques de l’ENG et du MPA étaient égales ou supérieures aux niveaux cibles basés sur leurs produits commercialisés (Nexplanon® et Depo-Provera®) pendant 90 jours et le MPA a démontré une cinétique de libération d’ordre zéro. Toutes les formulations présentaient des scores d’inflammation légère à modérée avec de faibles concentrations de TNF-α (0-3 pg/mL) et d’IL-6 dans le plasma (0-20 pg/mL). Les dépôts récupérés 90 jours après l’euthanasie ont atteint une dégradation de ~47 % d’après l’analyse GPC et contenaient ~5 % de ENG, ~20 % de DTG, 14-70 % de MPA et ~85 % de CAB. Il s’agit donc d’un premier ISFI biodégradable, amovible et injectable qui permet (1) la capacité de co-formuler un ARV (DTG ou CAB) et un contraceptif (ENG ou MPA) dans un seul ISFI, (2) une cinétique de libération de médicament soutenue et ciblée in vivo pendant 90 jours et (3) des formulations sûres et bien tolérées. Les études futures comprennent l’évaluation de la pharmacocinétique et de l’efficacité chez les primates non humains.
Cet article a été publié initialement dans le e-journal de « La Lettre de l’infectiologue » couvrant la conférence, nous le reproduisons ici avec leur aimable autorisation.
