Ainsi, il est clair que le taux de mutation élevé, l’adaptabilité conformationnelle majeure et les modifications d’immunogénicité apportées par la glycosylation de la protéine d’enveloppe sont des freins importants pour l’induction d’une réponse vaccinale efficace.
Alors que par le passé les stratégies vaccinales balançaient entre induire une réponse humorale et privilégier une réponse cellulaire1Lelièvre JD, Lévy Y. HIV-1 prophylactic vaccines: state of the art. J Virus Erad 2016;2(1):5-11., il existe actuellement un large consensus dans la communauté scientifique sur le fait que les futures stratégies devraient être capables de déclencher ces 2 types de réponse. Néanmoins, les efforts récents ont porté sur l’induction d’une réponse anticorps, qu’elle soit neutralisante ou pas2Lelièvre JD, Lévy Y. HIV-1 prophylactic vaccines: state of the art. J Virus Erad 2016;2(1):5-11..
Points forts
– L’essai thaïlandais RV144 a mis en évidence qu’une stratégie vaccinale anti-VIH “prime-boost” hétérologue (vecteur viral et vaccin protéique) permettait d’obtenir une protection de 31% contre l’infection.
– L’étude des corrélats de protection, dans cet essai, a montré que la protection semblait reposer sur l’induction d’anticorps non neutralisants dirigés contre la boucle V1/V2 de la protéine Env, ces anticorps ayant une activité ADCC.
– Malheureusement, les essais de phase IIb/III (HVTN702 et HVTN705) menés en Afrique n’ont pas permis de confirmer les résultats obtenus dans l’essai RV144. Les raisons exactes de ces échecs sont actuellement en cours d’analyse.
– La description des mécanismes qui concourent à l’induction d’anticorps neutralisants à large spectre en post-infection a permis la conceptualisation d’essais cliniques visant à induire de tels anticorps après la vaccination.
Cet article est paru dans le dossier thématique “Panorama vaccinal” de La Lettre de l’Infectiologue 2021;36(5):208-212.
L’essai thaïlandais RV144 et les essais post-Thaï
En 2009, pour la première fois, un essai de vaccination anti-VIH mené en Thaïlande, l’essai RV144, montrait des résultats positifs avec un effet de protection de 31,2% à la fin de l’essai, soit 3 ans après la dernière vaccination, et de 61% 1 an après celle-ci3Rerks-Ngarm S et al. Vaccination with ALVAC and AIDSVAX to prevent HIV-1 infection in Thailand. N Engl J Med 2009;361(23):2209-20.. Alors que plusieurs essais précédents s’étaient appuyés sur la seule utilisation de protéines d’enveloppe4Lelièvre JD, Lévy Y. HIV-1 prophylactic vaccines: state of the art. J Virus Erad 2016;2(1):5-11. 5Dolin R et al. The safety and immunogenicity of a human immunodeficiency virus type 1 (HIV-1) recombinant gp160 candidate vaccine in humans. NIAID AIDS Vaccine Clinical Trials Network. Ann Intern Med 1991;114(2):119-27., la stratégie vaccinale utilisée dans l’essai RV144 reposait sur une combinaison “prime- boost” hétérologue et la protéine AIDSVAX B/E déjà utilisée dans l’essai VAX0036Lelièvre JD, Lévy Y. HIV-1 prophylactic vaccines: state of the art. J Virus Erad 2016;2(1):5-11., ainsi qu’un vecteur viral de type poxvirus (ALVAC-HIV – vCP2438) codant pour les protéines Gag, Pol et Env (voir tableau I).
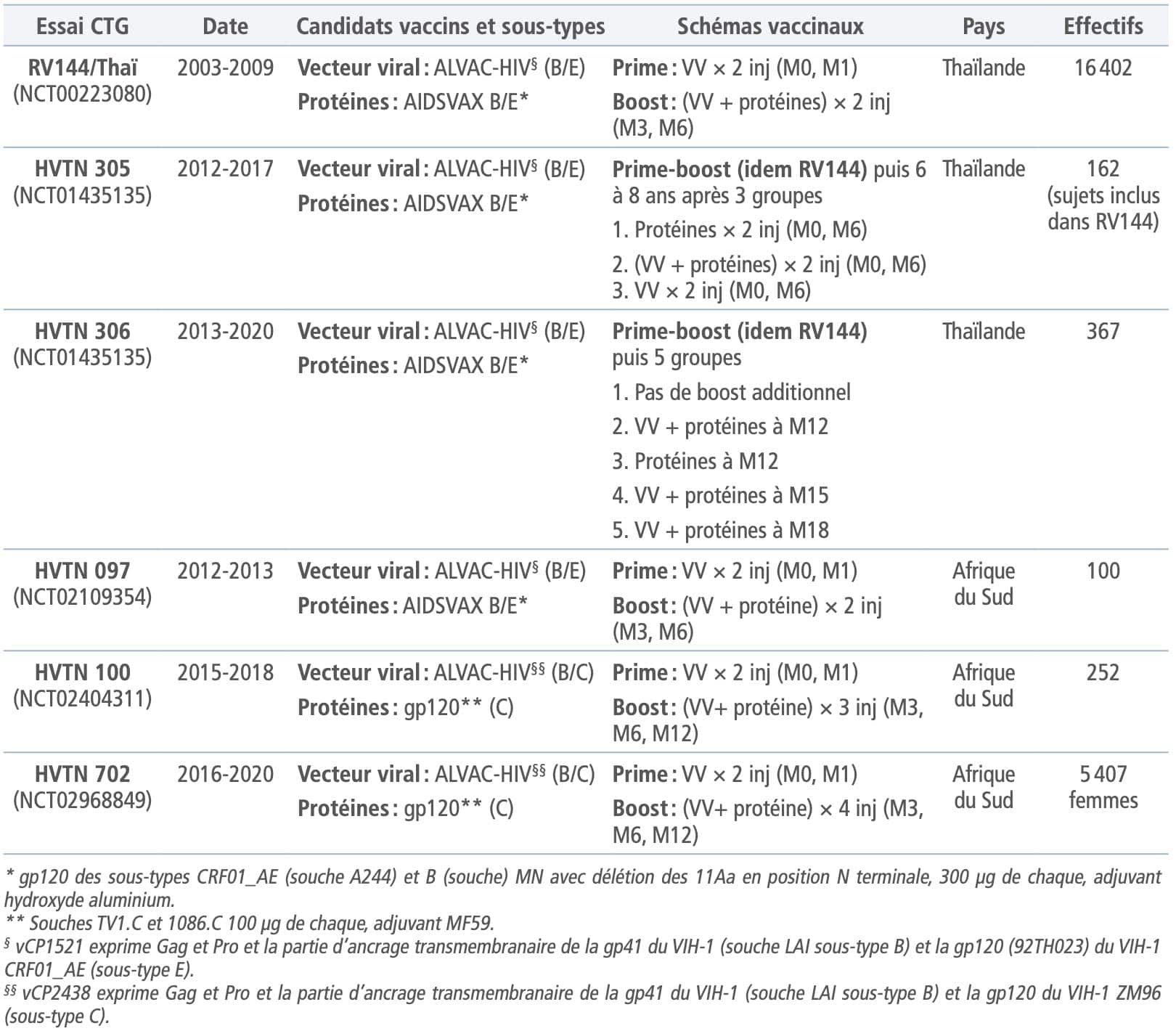
Cette association était à même d’induire une réponse immunitaire adaptative large, qui combinait une réponse cellulaire via le vecteur viral et une réponse humorale via l’utilisation d’une protéine d’enveloppe. Cet essai important en termes de nombre de volontaires inclus n’avait pas été conçu pour analyser de manière fine la réponse immunitaire. Les résultats encourageants obtenus ont conduit, d’une part, à tenter de décrire au mieux un ou des éventuels corrélats de protection et, d’autre part, à améliorer la stratégie vaccinale pour augmenter le taux et/ou la durée de protection.
Les corrélats de protection de l’essai RV144: le rôle des anticorps non neutralisants
Parmi les différents paramètres immunologiques analysés dans l’essai RV144, 2 ont montré initialement une corrélation avec l’infection : le taux d’IgAanti-Env circulantes corrélé positivement à l’infection et le taux d’anticorps anti-V1/V2 de Env corrélé lui négativement à l’infection. Afin d’asseoir la pertinence de ce dernier marqueur, des études génétiques virologiques (Sieve studies) ont été menées sur les souches virales des patients des groupes vaccin et placeboPlacebo Substance inerte, sans activité pharmacologique, ayant la même apparence que le produit auquel on souhaite le comparer. (NDR rien à voir avec le groupe de rock alternatif formé en 1994 à Londres par Brian Molko et Stefan Olsdal.) Elles ont mis en évidence que les souches de VIH-1 qui correspondaient à la séquence du vaccin et qui contenaient une lysine en position 169 dans ledomaine V2 semblaient être bloquées par la vaccination, venant ainsi conforter le rôle important des anticorps anti-V1/V2 dans la protection7Kim JH et al. Lessons from the RV144 Thai Phase III HIV-1 vaccine trial and the search for correlates of protection. Annu Rev Med 2015;66:423-37.. Ces anticorps se sont par ailleurs avérés actifs via leur activité ADCC8Kim JH et al. Lessons from the RV144 Thai Phase III HIV-1 vaccine trial and the search for correlates of protection. Annu Rev Med 2015;66:423-37.. Les essais VAX003 et VAX0049Lelièvre JD, Lévy Y. HIV-1 prophylactic vaccines: state of the art. J Virus Erad 2016;2(1):5-11. faisant appel à l’utilisation de protéines d’enveloppeproches (voir tableau I), les résultats immunologiques obtenus dans ces essais ont été comparés à ceux de l’essai RV144 afin de déterminer la pertinence des corrélats de protection. De ces analyses, il a pu être déterminé que le sous-type de l’anticorps anti-V1/ V2 –IgG3 en l’espèce– semblait plus déterminant que le taux10Kim JH et al. Lessons from the RV144 Thai Phase III HIV-1 vaccine trial and the search for correlates of protection. Annu Rev Med 2015;66:423-37.. C’est à mettre en parallèle avec la capacité des IgG3 à se fixer au récepteur du fragment Fcg et à lier le complément, paramètres associés à la protection contre d’autres infections virales. D’autres marqueurs ont été également liés dans des études ultérieures à la protection dans l’essai RV144, commeles anticorps anti-V3 et le score polyfonctionnel des réponses lymphocytaires T11Kim JH et al. Lessons from the RV144 Thai Phase III HIV-1 vaccine trial and the search for correlates of protection. Annu Rev Med 2015;66:423-37. 12Alter G, Barouch DH. Immune correlate-guided HIV vaccine design. Cell Host Microbe 2018;24(1):25-33.. Bien que de nombreuses questions demeurent concernant lavalidité de ces corrélats de protection, les résultats cliniques obtenus ont conduit à poursuivre des essais cliniques avec le même type de stratégie vaccinale.
Les essais de boost post-RV144: essais HVTN 305 et HVTN 306
L’objectif de l’essai HVTN 305 était d’apprécier la possibilité de rappeler des réponses anamnes- tiques chez des volontaires ayant participé à l’essai RV144, 6 à 8 ans après leur dernière vaccination13Rerks-Ngarm S et al. Randomized, double-blind evaluation of late boost strategies for HIV-uninfected vaccine recipients in the RV144 HIV vaccine efficacy trial. J Infect Dis 2017;215(8):1255-63.. Trois groupes ont été constitué, rece- vant, à 24 semaines d’intervalle, 1 ou 2 vaccins de RV144 (tableau I). Il a été observé qu’un rappel avec la protéine AIDSVAX B/E seule ou en association avec ALVAC-HIV augmentait significativement le taux d’anticorps anti-V1/V214Rerks-Ngarm S et al. Randomized, double-blind evaluation of late boost strategies for HIV-uninfected vaccine recipients in the RV144 HIV vaccine efficacy trial. J Infect Dis 2017;215(8):1255-63.. Cet effet était toutefois de courte durée, et le rappel ultérieur n’en augmentait pas l’ampleur. L’essai HVTN 306 a permis d’inclure de nouveaux volontaires qui ont reçu le même schéma vaccinal que celui de l’essai RV144, auquel était adjoint un boost supplémentaire à M12, M15 ou M18, avec les 2 vaccins (tableau I). Globalement, l’essai a montré que ces boosts ont permis de maintenir et d’augmenter les réponses immunitaires spécifiquesPitisuttithum P et al. Late boosting of the RV144 regimen with AIDSVAX B/E and ALVAC-HIV in HIV-uninfected Thai volunteers: a double-blind, randomised controlled trial. Lancet HIV 2020;7(4):e238-48..
Les essais post-RV144 menés en Afrique : essais HVTN 097, 100 et 702
Le premier essai, HVTN 097, visait à étudier la réponse immunologique dans la population africaine avec le même schéma que l’essai RV144 (tableau I). Ce schéma a induit des réponses des cellules T CD4+ spécifiques de Env, des anticorps anti-V1/V2, en particulier les IgG3, ainsi que les réponses de type ADCC de manière significativement plus élevées que chez les personnes incluses dans l’essai RV14415Gray GE et al. Immune correlates of the Thai RV144 HIV vaccine regimen in South Africa. Sci Transl Med 2019;11(510):1-17.. L’étape suivante (essai HVTN 100) a été d’étudier l’immunogénicitéImmunogénicité Capacité à produire une réponse immunitaire. du même type de stratégie vaccinale prime-boost en utilisant en lieu et place du sous-type E un sous- type C (tableau I)16Bekker LG et al. Subtype C ALVAC-HIV and bivalent subtype C gp120/MF59 HIV-1 vaccine in low-risk, HIV-unin- fected, South African adults: a phase 1/2 trial. Lancet HIV 2018;5(7):e366-e378.. Toutefois, il est à noter que, dans cet essai, la dose de protéine d’enveloppe était inférieure à celle de l’essai RV144, que l’adjuvant combiné à cette protéine était ici le MF59 et non plus l’aluminium, et que, à la suite des résultats de l’essai RV306, un boost tardif était introduit à M12 (tableau I). Cette combinaison vaccinale a induit une plus grande fréquence de réponses anti-Env, en particulier IgG3, et des réponses lymphocytaires T CD4+ significativement plus élevées par rapport à ce qui était observé dans RV144. La réponse IgG ayant dépassé le seuil attendu de 63% requis pour une efficacité vaccinale de 50% –calculé à l’aide d’un modèle de corrélation de protection V1/V2–, les résultats de cet essai ont permis de fournir un go pour la mise en place de l’essai de phase IIb HVTN 702. Les vaccins utilisés dans cet essai ont été les mêmes que ceux de l’essai HVTN 100 (tableau I). Il a été stoppé le 23 janvier 2020 après une analyse intermédiaire qui montrait une inefficacité de la stratégie, le nombre d’infections étant identique dans les 2 groupes17Gray GE et al. Vaccine efficacy of ALVAC-HIV and bivalent subtype C gp120–MF59 in adults. N Engl J Med 2021;384(12):1089-100.. Plusieurs explications ont été avancées pour analyser la différence d’efficacité entre les essais RV144 et HVTN 702. La première était d’ordre immunologique. Les études menées dans le modèle SIV montraient en effet que si la combinaison vaccinale utilisée dans HVTN 702 induisait bien la réponse immunologique systémique attendue, elle n’était pas associée à une protection contre l’infection contrairement à celle correspondant à l’essai RV14418Vaccari M et al. Adjuvant-dependent innate and adaptive immune signatures of risk of SIVmac251 acquisition. Nat Med 2016;22(7):762-70.. Les auteurs de cette étude montraient que les réponses muqueuses induites par les 2 types de combinaisons vaccinales étaient différentes, la protection induite par les vaccins RV144 étant associée notamment à l’induction de cellules lymphoïdes innées digestives, qui produisent de l’interleukine-17, ainsi qu’à celle d’IgG muqueuses anti-V2 de la gp120, la différence entre les 2 régimes étant pour les auteurs à rapporter au changement d’adjuvant19Vaccari M et al. Adjuvant-dependent innate and adaptive immune signatures of risk of SIVmac251 acquisition. Nat Med 2016;22(7):762-70.. La plus faible quantité d’antigène protéique (cf. supra) a également été évoquée comme élément pouvant expliquer une moindre efficacité. La dernière explication concernait la différence d’incidence de l’infection dans les différentes populations de volontaires: 0,28% pour 100 personnes-années dans l’essai RV144 contre 4% chez les femmes et 1% chez les hommes dans l’essai HVTN 70220Kim JH et al. Lessons from the RV144 Thai Phase III HIV-1 vaccine trial and the search for correlates of protection. Annu Rev Med 2015;66:423-37.. «Il se peut ainsi que la protection ait été complètement dépassée» (Anthony Fauci).
Les essais de vaccination mosaïque: essais HVTN 705 et 706
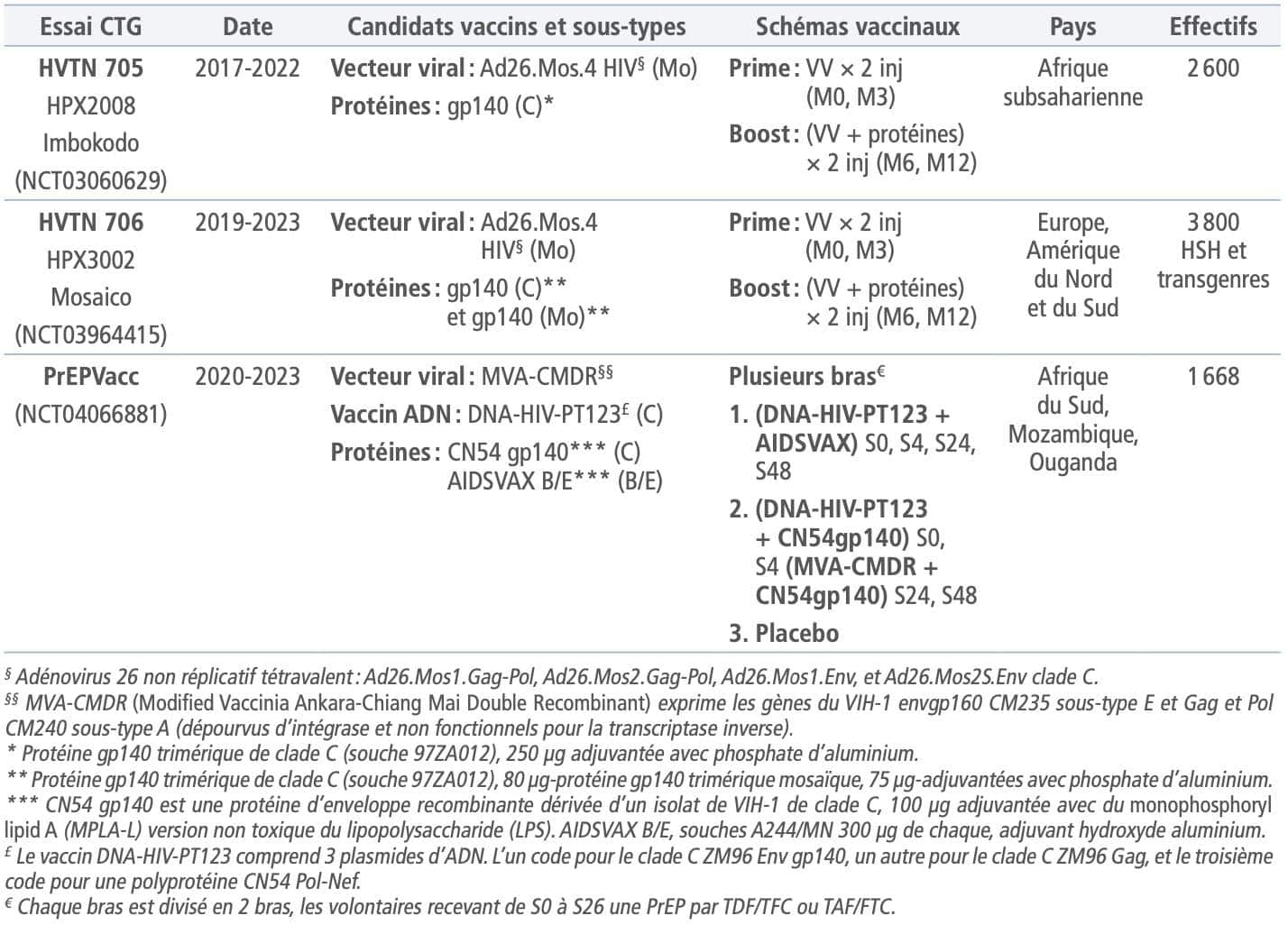
Les stratégies prime-boost hétérologues de type RV144 ont également été poursuivies par le laboratoire Janssen qui développe, depuis plusieurs années, un vaccin à vecteur viral à base d’adénovirus. Ce vaccin repose sur l’utilisation d’un adénovirus de sérotype 26 rendu incompétent pour la réplication chez l’homme grâce à la délétion du gène E1, le gène qui code pour l’antigène vaccinal étant inséré au niveau de cette région. Ce vecteur utilisé dans la mise au point de plusieurs vaccins –VIH, VRS, Zika, paludisme– est celui du vaccin anti-Ebola. Dans le modèle NHP, les ajustements au cours du temps ont permis de passer d’une protection initiale de 18% en utilisant ce vecteur seul à une protection de 66% en association prime-boost avec un vaccin protéique21Alter G, Barouch DH. Immune correlate-guided HIV vaccine design. Cell Host Microbe 2018;24(1):25-33.. Outre ces caractéristiques immunologiques particulières, le vaccin Ad26 anti-VIH mis au point par Janssen a la particularité de permettre l’expression d’antigènes vaccinaux mosaïques. Ainsi, ce vecteur n’inclut pas, comme l’ALVAC des essais précédents, des régions entières du génome viral codant pour Pol, Gag ou Env, mais des fragments de plus petite taille provenant de différents sous-types du virus, générés après analyse bio-informatique, afin de faire produire des protéines contenant le maximum d’épitopes potentiels des lymphocytes T.
La protéine d’enveloppe utilisée en combinaison avec ce vecteur est également différente, disponible sous une forme trimérique (cf. infra) et également sous une forme mosaïque comportant différents sous-types (tableau II). Si ces vaccins ont montré leur pertinence dans des essais de challenge viral chez l’animal et dans des essais de phase I/II chez l’homme22Barouch DH et al. Evaluation of a mosaic HIV-1 vaccine in a multicentre, randomised, double-blind, placebo-controlled, phase 1/2a clinical trial (APPROACH) and in rhesus monkeys (NHP 13-19). Lancet 2018;392(10143):232-43., les résultats préliminaires du premier des 2 essais de phase IIb menés avec cette stratégie,HVTN 705 (tableau II), viennent d’être communiqués et sont décevants, la vaccination n’apportant pas de bénéfice. L’essai HVTN 706 est cependant poursuivi, et les résultats de celui-ci sont attendus pour 2024.
Les essais post-Thaï avec des vecteurs différents: l’essai PrEPVacc
Le dernier essai de phase II/III qui s’inscrit dans la continuité de l’essai RV144 est l’essai PrEPVacc. Si celui-ci s’inscrit dans la même logique d’induction d’une protection fondée sur l’induction d’anticorps neutralisants et reposant sur l’utilisation du même type d’antigènes, ceux-ci seront exprimés par des plateformes différentes et administrés selon un timing différent. Se basant sur des résultats antérieurs, les promoteurs de cet essai ont proposé l’utilisation d’un vaccin ADN pour remplacer le vecteur viral et la coadministration du vaccin protéique avec celui-ci (tableau II). Les résultats d’un essai de phase II a ainsi permis de montrer, notamment, que la coadminis- tration des vaccins protéiques permettait d’obtenir plus rapidement et de manière plus prolongée des anti-V1/V223Pantaleo G et al. Safety and immunogenicity of a multivalent HIV vaccine comprising envelope protein with either DNA or NYVAC vectors (HVTN 096): a phase 1b, double-blind, placebo-controlled trial. Lancet HIV 2019;6(11):e737-e749.. Cet essai vise également à répondre à la problématique du groupe placebo et à la nécessaire administration d’une PrEPPrEP Prophylaxie Pré-Exposition. La PrEP est une stratégie qui permet à une personne séronégative exposée au VIH d'éliminer le risque d'infection, en prenant, de manière continue ou «à la demande», un traitement anti-rétroviral à base de Truvada®. en introduisant systématiquement celle-ci de S0 à S26 (tableau II).
La piste des anticorps neutralisants à large spectre
Pour importantes que soient ces stratégies, elles ne conduisent pas à l’induction d’anticorps neutralisants à large spectre, seul moyen de s’assurer d’une protection importante à l’échelon individuel. Des travaux menés dans des cohortes de sujets à risque d’infection ont montré que des anticorps neutralisants à large spectre (broadly neutralizing HIV-1 antibodies, bNAb) –capables de bloquer l’infection de plus de 90 à 95 % des souches virales– apparaissaient chez 1% des individus infectés par le VIH-1. L’analyse de la génération postinfection de ces anticorps a permis d’envisager la réalisation d’études vaccinales visant à les induire in vivo, tout d’abord chez l’animal et maintenant chez l’homme. Pour cela, il a fallu définir la nature des antigènes pour améliorer leur structure. On sait dorénavant que ces anticorps sont générés à la suite d’un cross-talk entre le virus et la réponse lymphocytaire B, les modifications de l’un venant impacter la maturation de l’autre et vice versa24Haynes BF, Mascola JR. The quest for an antibody-based HIV vaccine. Immunol Rev 2017;275(1):5-10.. Ainsi, l’utilisation d’un seul antigène –en l’espèce d’une protéine d’enveloppe– n’est pas suffisante pour induire la maturation de lymphocytes B susceptibles de les produire. Le premier point crucial a donc été celui de la caractérisation d’antigènes, dit germline, susceptibles de mobiliser les lymphocytes B naïfs capables de donner naissance, après maturation, aux cellules productrices de ces anticorps. Le deuxième point est la nécessaire utilisation successive de plusieurs antigènes différents, mais proches, pour mimer ce qui se produit lors de l’infection. En ce qui concerne la structure des protéines, l’immunogénicité des protéines d’enveloppe a été clairement améliorée par l’obtention d’une structure trimérique, qui est celle présente habituellement à la surface des virions. Celle-ci a été rendue possible grâce à la réalisation de ponts disulfures entre les protéines d’enveloppe, ce qui permet d’obtenir des protéines appelées SOSIP25Haynes BF, Mascola JR. The quest for an antibody-based HIV vaccine. Immunol Rev 2017;275(1):5-10.. Enfin, des travaux qui portent sur des modifications de laglycosylation des protéines d’enveloppe permettent de modifier et de cacher des épitopesEpitope Partie d’une molécule capable de stimuler la production d’un anticorps. potentiellement distrayants26Haynes BF, Mascola JR. The quest for an antibody-based HIV vaccine. Immunol Rev 2017;275(1):5-10.. Si cette piste de recherche est moins avancée sur le plan clinique, un essai de phase I, porteur de beaucoup d’espoirs, combinant une vaccination par des vaccins ARNm codant pour les protéines eOD-GT8 60mer (germline)27Jardine JG et al. HIV-1 broadly neutralizing antibody pre- cursor B cells revealed by germline-targeting immunogen. Science 2016;351(6280):1458-63. à celle codant pour les protéines Core-g28v2 60mer (boost), vient d’être récemment mis en place (NCT05001373).
Qu’attendre pour demain?
La mise au point d’un vaccin anti-VIH reste une recherche complexe du fait même de la nature de l’infection, semée dans le passé d’espoirs et de déceptions. À l’heure actuelle, la piste la plus prometteuse est celle de l’induction d’anticorps à large spectre. Elle devrait être dynamisée par le succès du vaccin anti-Covid-19 ayant permis de valider la pertinence de nouvelles plateformes vaccinales, qui seront demain un atout pour l’ensemble des recherches vaccinales.
