D’après Colson AE et al., abstr. PS15.5.LB actualisé
Il s’agit d’une étude randomisée, ouverte, incluant des adultes virologiquement contrôlés sous TAF/FTC/BIC. 52 participants recevaient ISL 2 mg + LEN 300 mg une fois par semaine et 52 autres participants poursuivaient leur traitement quotidien par TAF/FTC/BIC (figure 1). Les participants du groupe ISL + LEN ayant terminé la phase randomisée de 48 semaines avaient la possibilité d’entrer dans une phase d’extension de 48 semaines supplémentaires. Les critères d’évaluation jusqu’à la semaine 96 incluaient l’efficacité virologique, l’observance (mesurée par le comptage des comprimés), la tolérance, le nombre de lymphocytes T CD4+, le nombre total de lymphocytes, le poids et l’indice de masse corporelle (IMC).

L’âge médian des participants était de 40 ans, 19 % étaient des femmes. 47/52 participants du bras ISL + LEN ont poursuivi dans la phase d’extension. L’observance moyenne jusqu’à la semaine 96 était remarquable, atteignant 99 % (selon le compte des comprimés pris, néanmoins aucune donnée n’était disponible sur le possible non-respect des délais attendus entre les prises). Aucun participant n’a présenté de rebond virologique (CVp ≥ 50 copies/mL), aussi, aucune résistance émergente à l’ISL ou au LEN n’a été détectée (figure 2). Sur l’ensemble de la période de 96 semaines, 10 participants (19 %) ont rapporté des effets indésirables liés au traitement de l’étude, mais aucun événement de grade ≥ 3 imputable à ISL ou LEN n’a été observé. Deux participants (3,8 %) ont interrompu l’étude en raison d’effets indésirables non liés au traitement. À noter, parmi ces deux participants, la survenue d’une hépatite B aiguë qui souligne à nouveau, si besoin était, l’absolue nécessité de vacciner les PVVIHPVVIH Personne vivant avec le VIH contre l’hépatite B, notamment quand ils reçoivent un traitement ARV ne contenant pas de ténofovir. À la semaine 96, les variations moyennes du nombre de CD4 et de lymphocytes totaux n’étaient pas significatives. L’évolution médiane du poids était de +0,1 kg (IC95 : –2,6 à 1,8), et celui de l’IMC de +0,04 kg/m2 (IC95 : –0,9 à 0,6), c’est-à-dire non significative.
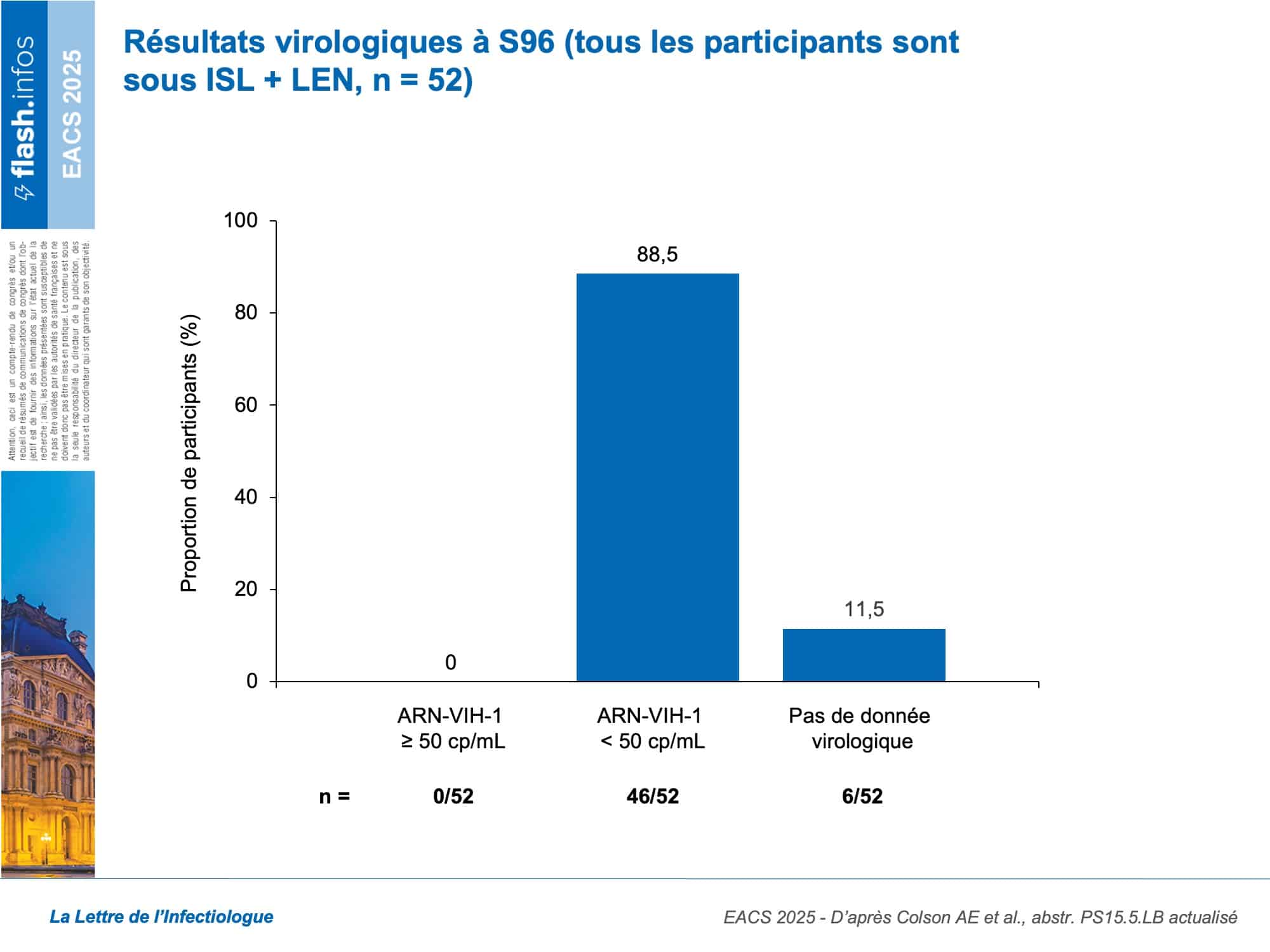
En conclusion, le schéma hebdomadaire par voie orale associant ISL + LEN permettait de maintenir une suppression virologique complète jusqu’à 96 semaines. Le traitement était bien toléré. Ces résultats vont dans le sens du développement de cette association prometteuse, s’agissant d’une stratégie long acting orale, positionnée entre les traitements ARV oraux conventionnels et les traitements long acting injectables. Deux essais de phase III sont en cours : ISLEND-1 et ISLEND-2.
Cet article a été précédemment publié dans le Flash-Infos de la Lettre de l’infectiologue d’Edimark consacré à l’EACS. Nous le reproduisons ici avec leur aimable autorisation.
