Anomalies de fermeture du tube neural en fonction du traitement antirétroviral dans l’étude Tsepamo, Botswana
Rebecca Zash, Harvard T.H. Chan School of Public Health, United States
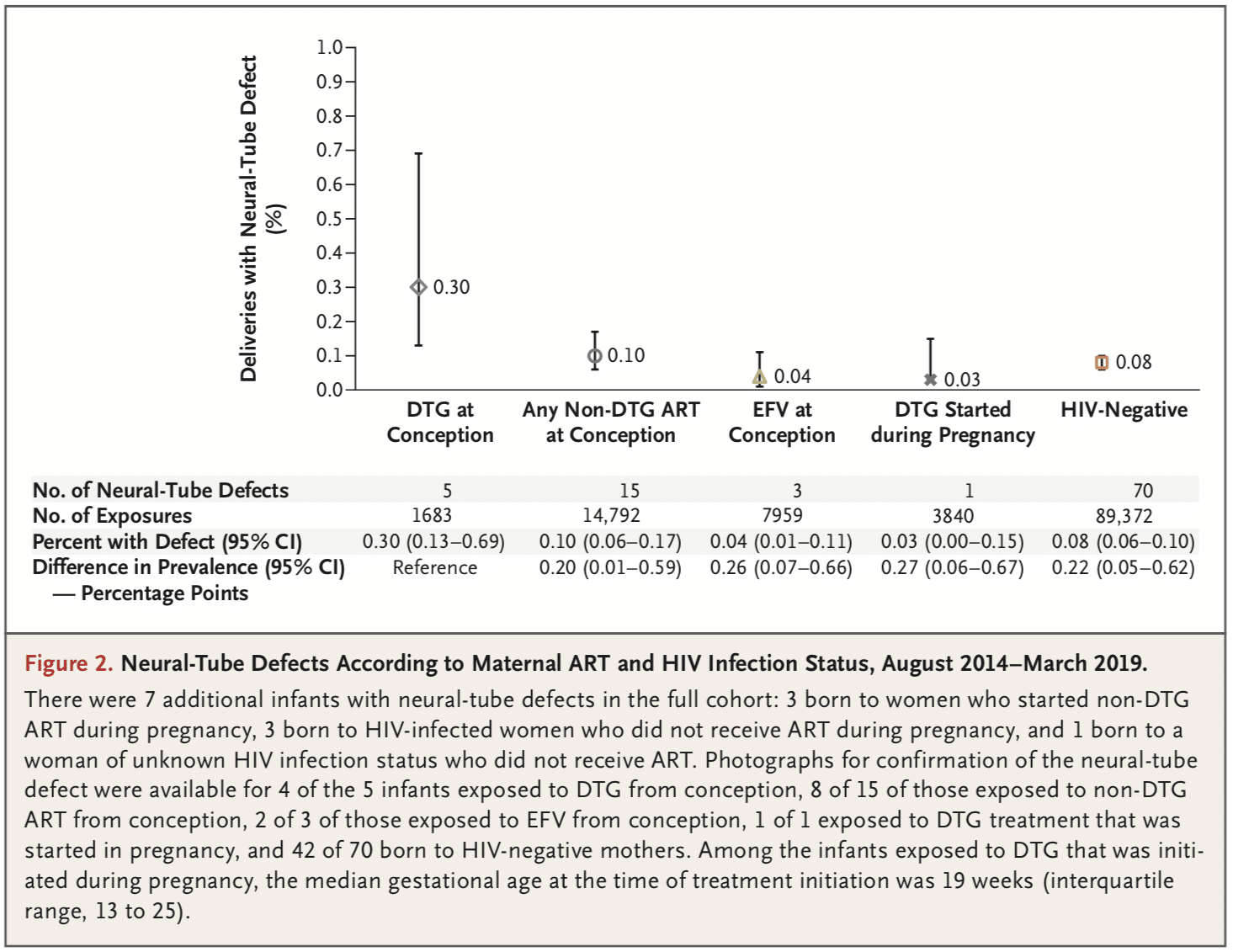
L’étude Tsepamo a été mise en place en 2014 pour étudier les issues de grossesses chez les femmes vivant avec le VIH, notamment concernant les risques d’anomalies de fermeture du tube neural (AFTN) sous éfavirenz (EFV). Au cours de l’étude, le dolutégravir (DTG) a été introduit en 1ère ligne dans le programme de traitement du Botswana. Dans une 1ère analyse menée en avril 2018, l’incidence des AFTN était de 4/426 (0.94%) sous traitement comportant du DTG à la conception, 10 fois plus élevée que dans les autres groupes d’exposition et chez les femmes non-infectées par le VIH ce qui a amené l’OMS à déconseiller temporairement l’utilisation du DTG chez les femmes en âge de procréer. Le très grand intervalle de confiance a poussé à poursuivre et élargir l’étude à de nouveaux sites.
Avec une année de recrutement supplémentaire, l’incidence d’AFTN est de 0.3% avec le DTG au moment de la conception, contre 0.1% pour les femmes non exposées aux autres ARV au moment de la conception. Soit une différence de 0,2%. Elle a donc considérablement baissé depuis l’alerte initiale, car un seul cas supplémentaire a été détecté depuis, pour un plus grand nombre de nouvelles grossesses, portant le nombre de cas sous DTG à 5/1683 grossesses, contre 15/14792 chez les femmes sous traitement ARV à la conception sans DTG. Il existe donc toujours un petit sur-risque avec le DTG par rapport aux autres antiviraux, mais ce sur-risque, pour un évènement qui reste très rare, a incité l’OMS à ne plus déconseiller l’utilisation du DTG chez les femmes en âge de procréer.
Elle a donc considérablement baissé depuis l’alerte initiale, car un seul cas supplémentaire a été détecté depuis, pour un plus grand nombre de nouvelles grossesses, portant le nombre de cas sous DTG à 5/1683 grossesses, contre 15/14792 chez les femmes sous traitement ARV à la conception sans DTG. Il existe donc toujours un petit sur-risque avec le DTG par rapport aux autres antiviraux, mais ce sur-risque, pour un évènement qui reste très rare, a incité l’OMS à ne plus déconseiller l’utilisation du DTG chez les femmes en âge de procréer.
Les systèmes habituels de pharmacovigilance sont conçus pour détecter des signaux assez importants, pas des alertes de basse intensité. L’avantage de Tsepamo est d’avoir été conçu pour détecter ce type de signal ; son inconvénient est qu’il est difficile de savoir quoi faire d’un signal faible. Cette problématique fait l’objet d’un article très intéressant paru dans le Journal de l’IAS (.pdf).
Les premiers résultats de l’étude Tsepamo sont également communiqués dans un bref article du New England Journal of Medicine de 2018 (.pdf) et la version définitive dans un article complet du 22 juillet 2019 (.pdf).
Répondre au signal de sureté concernant le dolutégravir: données supplémentaires du Botswana
Mmakgomo Mimi Raesima, Botswana Ministry of Health and Wellness, Botswana
Le Botswana a positionné le DTG en 1ère ligne de traitement dès mai 2016. Suite aux premiers résultats de TSEPAMO, le ministère de la santé du Botswana a mis en place un programme spécifique pour étendre la surveillance à 4 sites supplémentaires, soit 22 sites au total en englobant les sites « Tsepamo », ce qui couvre 92% des grossesses et naissances du pays. Les données de toutes les naissances de femmes ont été collectées sur les sites, et entrées dans une base de données.
Les CDC ont analysé les données anonymisées. En 6 mois, on dénombre 3376 grossesses sur les 22 sites, dont 24 % chez des femmes vivant avec le VIH, dont 73% étaient sous ARV à la conception : 152 sous DTG (28%), 69% sous EFV Trois cas d’AFTN ont été retenus pendant la période de surveillance (deux probables et un certain) : 1/152 grossesses pour le DTG et 2/2328 grossesses chez les femmes VIH-, ce qui donne une incidence de 0.66 % sous DTG versus 0.09 % chez les femmes séronégatives et 0 chez les femmes vivant avec le VIH ne recevant pas de DTG à la conception.
Le risque sous DTG reste inférieur à 1%, comme dans l’étude TSEMAMO. On est donc en présence d’un sur-risque statistiquement significatif, mais qui reste très faible.
Pas de survenue d’anomalies de fermeture du tube neural pour 382 femmes sous dolutégravir au moment de la conception au Brésil
Fernanda Fernandes Fonseca, Ministry of Health, Brazil
Le Brésil propose une prise en charge gratuite du VIH depuis 1996. Au moment du signal venant de l’étude TSEPAMO, le DTG était déjà largement utilisé car mis en première ligne en 2017. Le système de surveillance brésilien est très particulier car totalement informatisé (système SICLOM) et dépendant du seul canal gouvernemental. Il permet assez facilement de mettre en place des enquêtes spécifiques, comment cela a été fait pour le DTG. Une surveillance spécifique de toutes les grossesses sous inhibiteurs d’intégrases à donc été mise en place en 2018. Sur 3390 grossesses pendant cette période, 2507 disposaient de dossiers complets, aucun cas d’AFTN n’est signalé chez des femmes sous traitement ARV au moment de la conception. Deux cas d’AFTN sont signalés chez des femmes mises sous traitement plus tardivement : un sous EFV mis en place après 9 semaines et une sous RAL après 10 semaines. L’incidence habituelle des AFTN au Brésil est de 0,006%, soit 6 cas pour 100 000 naissances, avec une politique de prévention par acide folinique pendant la grossesse.
La surveillance a été étendue aux avortements et mort-nés, qui ne retrouve pas d’anomalie non plus. Compte tenu des faibles effectifs, une surveillance active se poursuit.
Note du rédacteur : En pratique, compte-tenu de l’incidence habituelle très faible des AFTN au Brésil, il n’est pas exclu que l’étude soit sous-dimensionnée pour montrer une faible augmentation d’incidence, il est donc important que la surveillance spécifique se poursuive.
Recommandations actualisées de l’OMS pour le traitement antirétroviral de première ou seconde ligne incluant le dolutégravir
Meg Doherty, World Health Organization, Switzerland
Les nouvelles recommandations de l’Organisation mondiale de la Santé (OMS) 2019 pour les premières lignes de traitement ont été modifiées et sont communiquées pour la première fois. L’ensemble des données disponibles jusqu’au début de l’été 2019 ont été prises en compte. Elles prennent en compte les nouvelles données de TSEPAMO avec un risque global d’AFTN de 0.36% sous DTG. Compte-tenu de la faible incidence, même si elle est plus importante qu’avec d’autres molécules, le DTG a été repositionné en 1ère ligne sans restriction, y compris chez les femmes en âge de procréer, mais l’OMS recommande la poursuite de la surveillance de la neurotoxicité du DTG chez le fœtus et de bien informer les mères sur les rapports bénéfices risques.
Ce texte a été publié sur le site du COREVIH Bretagne, nous le reproduisons ici avec l’aimable autorisation de son auteur, le Dr Cédric Arvieux.
