D’après Spinner C et al., abstr. 126, actualisé.
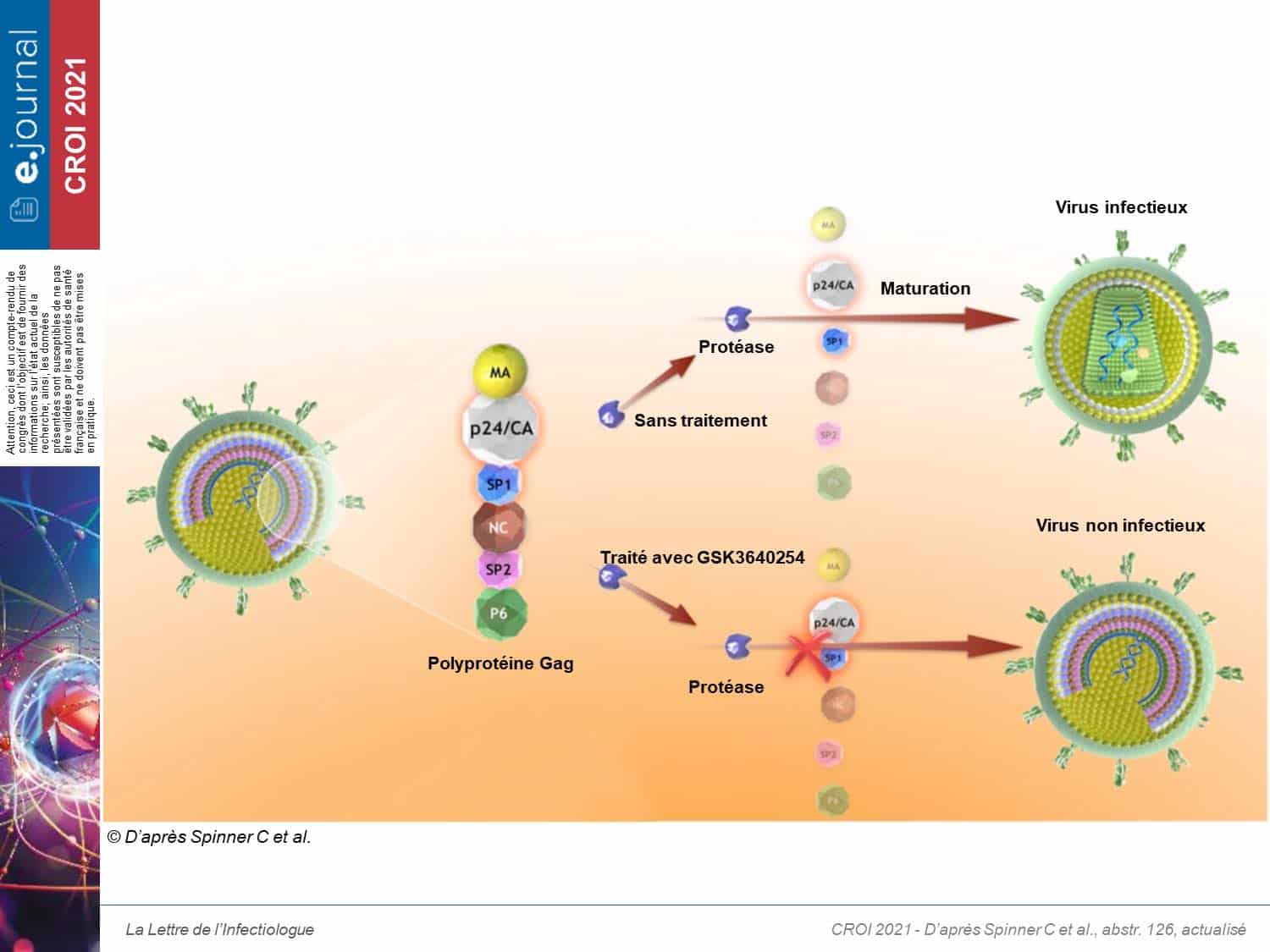
Cette étude de phase IIa randomisée, en double insu, a évalué contre placeboPlacebo Substance inerte, sans activité pharmacologique, ayant la même apparence que le produit auquel on souhaite le comparer. (NDR rien à voir avec le groupe de rock alternatif formé en 1994 à Londres par Brian Molko et Stefan Olsdal.) l’efficacité, la tolérance et la pharmacocinétique du GSK’254 administré en monothérapie et en une fois par jour, avec un repas à teneur en graisses modérées, chez des adultes naïfs de traitement et infectés par le VIH-1.
Dans la première partie (n = 14), les patients ont reçu GSK’254 à la dose de 10 ou 200 mg pendant 10 jours. Dans la seconde partie (n = 20), les patients ont reçu GSK’254 à la dose de 40, 80 ou 140 mg pendant 7 jours, afin de diminuer le risque de survenue de la résistance. Le critère d’évaluation primaire était la variation maximale de la charge viraleCharge virale La charge virale plasmatique est le nombre de particules virales contenues dans un échantillon de sang ou autre contenant (salive, LCR, sperme..). Pour le VIH, la charge virale est utilisée comme marqueur afin de suivre la progression de la maladie et mesurer l’efficacité des traitements. Le niveau de charge virale, mais plus encore le taux de CD4, participent à la décision de traitement par les antirétroviraux. à partir de J1. Les critères d’évaluation secondaires étaient la tolérance et la pharmacocinétique.
Sur les 34 patients qui ont reçu GSK’254 (n = 6/dose) ou placebo (n = 4), 94 % étaient des hommes ; la moyenne d’âge était de 31,8 ans. La charge virale moyenne à l’inclusion était de 4,57 log10 cp/mL. La diminution de la charge virale sous GSK’254 variait de −0,36 à −2,01 ; les baisses les plus importantes étant observées avec les doses de 200 et 140 mg, respectivement (tableau). Les résultats pharmacocinétiques montraient une relation dose-efficacité (figure).
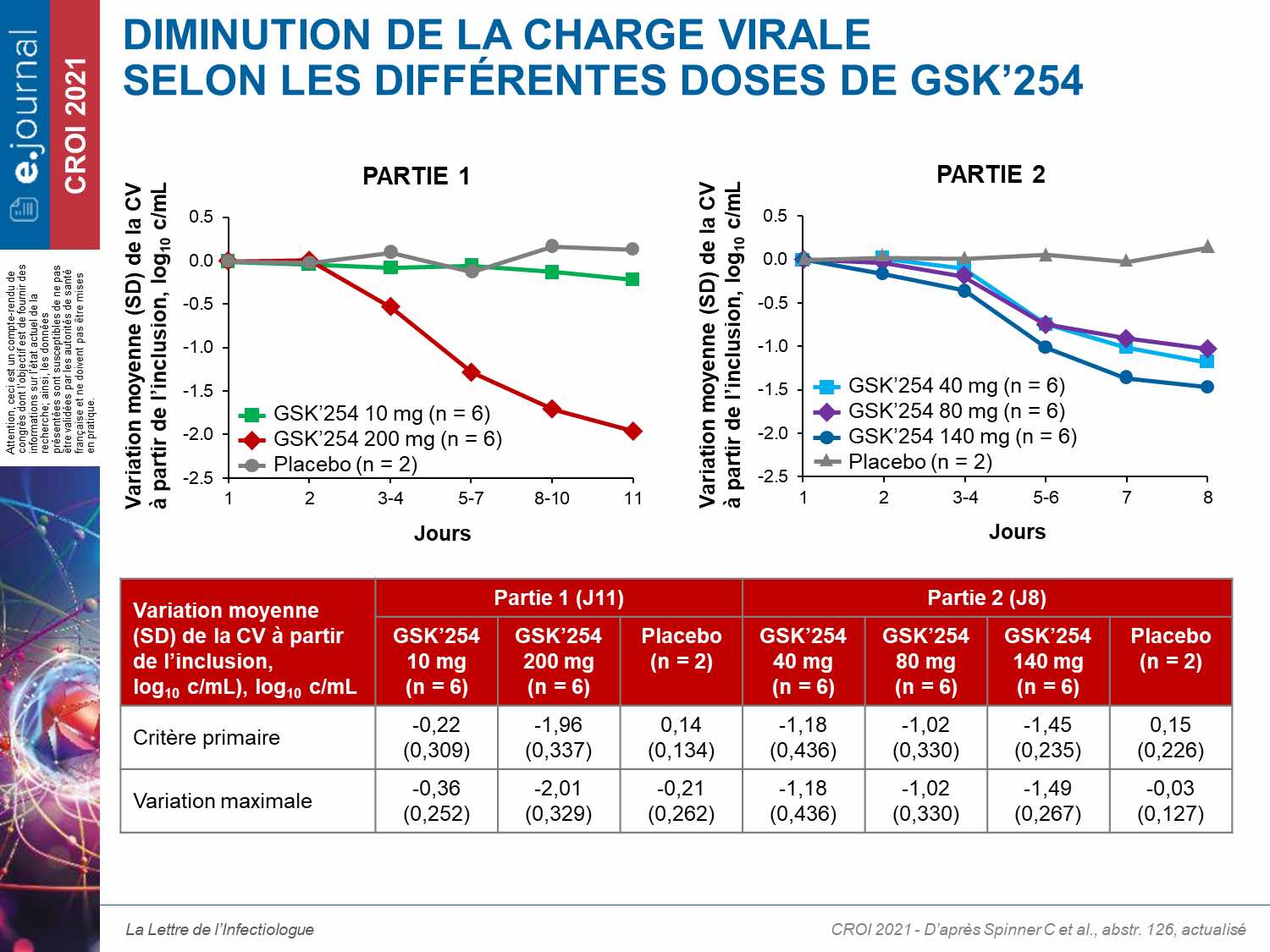
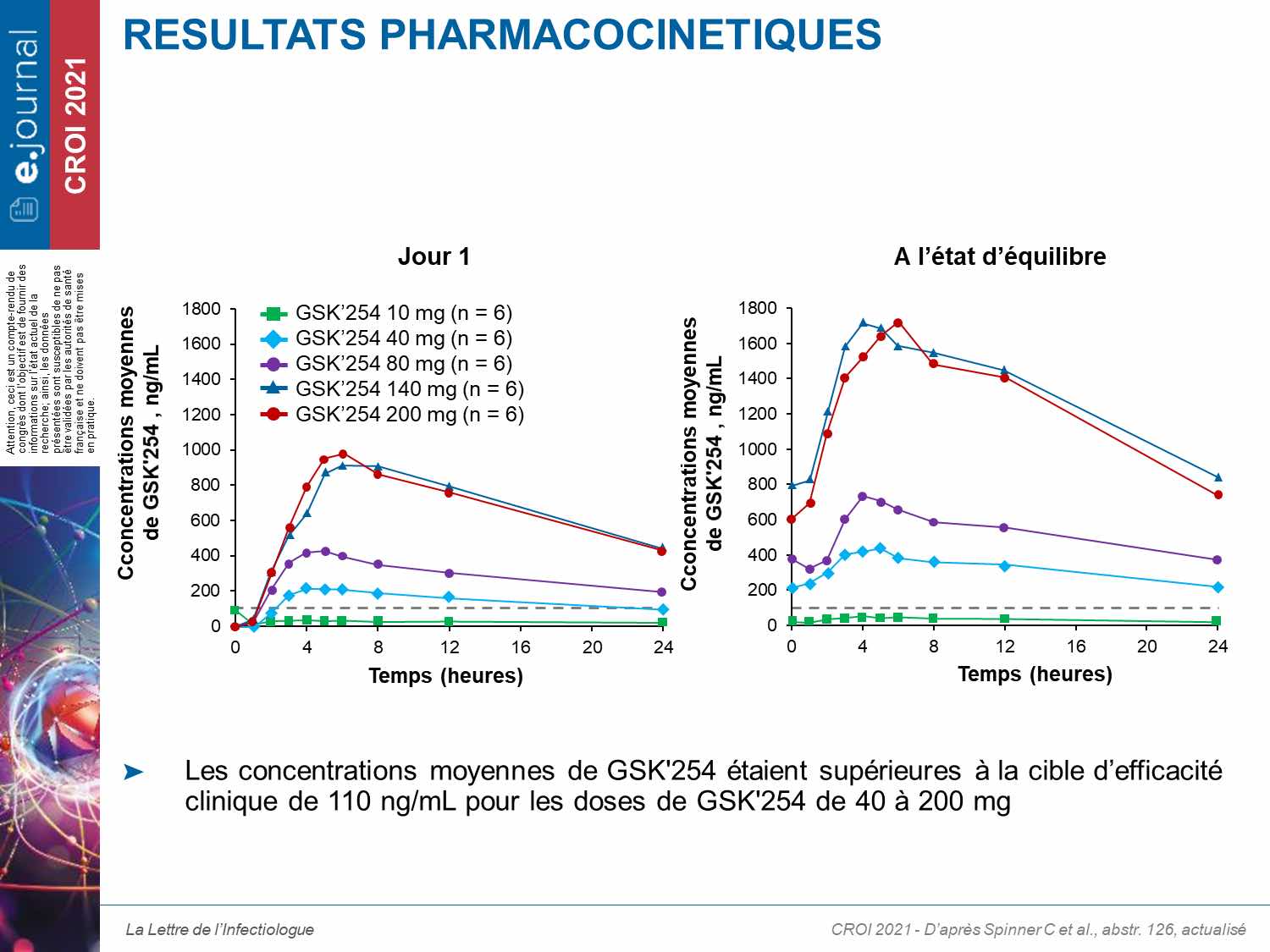
Dans la première partie de l’essai, 4 des 6 patients du groupe de 200 mg ont développé une résistance avec la sélection à J11 de la mutation A364V. En revanche, sous une monothérapie plus courte, aucune résistance n’a été observée dans la deuxième partie. Des effets indésirables légers à modérés ont été observés chez 65 % des patients sans conduire à l’arrêt du traitement. Deux effets indésirables graves, non liés au traitement (cardiomyopathie congestive et abcès anal), ont été rapportés.
La tolérance satisfaisante et la relation dose-efficacité de cette étude confortent l’étude de phase IIb en cours.
Cet article a été publié initialement dans le e-journal de « La Lettre de l’infectiologue » couvrant la conférence, nous le reproduisons ici avec leur aimable autorisation.
